
【题目】碳酸钠俗称纯碱或苏打,在生活、生产和实验硏究中均有广泛应用。
(配制溶液)配制溶质质量分数分別为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是______(填字母)。
a.用托盘天平称取2gNa2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ |
溶质质量分数 | 1% | 2% | 4% |
溶液pH | 11.62 | 11.76 | 11.90 |
分析I、Ⅱ、Ⅲ三组数据可得出的结论是________。
(制备物质)用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
(已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀)
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是______(填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:![]() ,则X的化学式为___________。
,则X的化学式为___________。
(标定浓度)标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于1g·mL-1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数_____(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将_____(填“偏大”、“偏小”或“无影响”)。
【答案】ab 25℃时,Na2CO3溶液的溶质质量分数越大,碱性越强 b Fe(OH)3 0.73% 偏大
【解析】
(1)配制50g、4%的碳酸钠溶液,需要称量碳酸钠的质量为:50g×4%=2g,需要称量水的体积为:50g-2g=48g,48g÷1g/mL=48mL。
a、根据分析可知,应该用托盘天平称量碳酸钠固体2g。a正确;
b、通过分析可知,需要量取48mL的水,则需要50mL的量筒。b正确;
c、碳酸钠溶液是液体,应该使用细口瓶盛装,并且用贴上标签。c错误。
故答案为:ab;
(2)通过图表可知,25℃时,碳酸钠溶液的溶质质量分数越大,溶液的pH越大,则溶液的碱性越强。故答案为:25℃时,Na2CO3溶液的溶质质量分数越大,碱性越强;
(3)根据提示信息可知,当溶液的pH>8.8时,Fe2+会完全生成Fe(OH)2沉淀。而该反应的目的是制备FeCO3沉淀,碳酸钠的水溶液呈碱性,则可能会产生副产物Fe(OH)2沉淀。如果将FeSO4加入Na2CO3溶液中,则碳酸钠溶液呈碱性,存在OH-,pH>7,很容易生成Fe(OH)2沉淀。若将Na2CO3溶液加入FeSO4溶液中,此时Fe2+是过量的,而且此时溶液显酸性,Fe2+不易产生Fe(OH)2沉淀,此时CO32-很容易和Fe2+结合为沉淀析出。故答案为:b;
(4)根据质量守恒定律可知,反应前后原子的个数相同。则反应前,有4个铁原子、4个碳原子、12个氢原子、20个氧原子,反应后有4个碳原子、8个氧原子,相差了4个铁原子、12个氢原子、12个氧原子,则X的化学式为Fe(OH)3。故答案为:Fe(OH)3;
(5)①消耗盐酸的质量为:20mL×1g·mL-1=20g。
设反应消耗的HCl的质量为x。
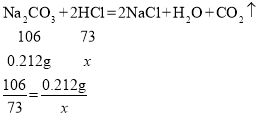
解得x=0.146g
则盐酸的溶质质量分数为:![]() 。
。
②若碳酸钠没有充分干燥,则实际的碳酸钠的质量小于0.212g,则消耗的HCl的质量小于对应的0.146g,对应消耗的盐酸溶液的质量也小于20g。但是进行相关计算时,仍然会按照“碳酸钠的质量为0.212g”进行计算,则会导致计算溶质的质量分数时,计算的参加反应的HCl的质量依然为0.146g,但是实际消耗的溶液的质量减少了,则会导致计算出的溶质质量分数偏大。故答案为:偏大。


科目:初中化学 来源: 题型:
【题目】(6分)高氯酸(HClO4)和亚氯酸钠(NaClO2)在工业上有广泛的用途,其制备工艺流程如下:

请回答下列问题:
(1)HClO4中Cl元素的化合价是 。
(2)反应器I中的生成物有HClO4、ClO2、NaHSO4、H2O,其中属于氧化物的是 。
(3)反应器II中发生反应的化学方程式为2ClO2+SO2+4NaOH=2NaClO2+X+2H2O,则X的化学式是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组同学,将一定量的稀硫酸滴入9.3g氢氧化钠和碳酸钠的固体混合物中,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
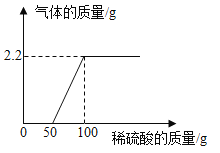
(1)产生二氧化碳气体的质量为____;
(2)混合物与稀硫酸恰好完全反应时所得溶液中溶质的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组制取氧气,并尝试回收部分药品。可能用到的部分装置如图。
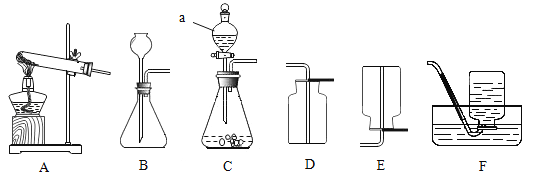
(1)上图中仪器a的名称是_______________。
(2)用双氧水和MnO2制氧气。发生反应的化学方程式为_____,收集氧气的装置可选用_____(填字母)。
(3)加热KClO3固体制氧气(1.5gMnO2作催化剂),并对KClO3完全分解后的残留固体进行分离。(已知反应原理为: )
)
①发生装置应选用____________(填字母)。
②KCl的溶解度曲线如图所示。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲将KCl全部溶解,至少应加入该温度下蒸馏水的体积约________(填字母)。
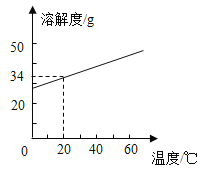
a.5 mL
b. 10 mL
c. 20 mL
d. 30 mL
③对溶解所得混合物进行过滤,滤渣经处理得MnO2。从滤液中获得KC1晶体的最佳方法是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
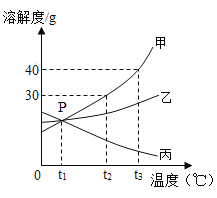
(1)P点表示在温度t1℃时,三种物质的溶解度__________。
(2)t2℃时,在温度变化的情况下要将丙的不饱和溶液变成饱和溶液的方法是___________(任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是______g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为__________。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学科学已经日益渗透到社会生活的各个方面,它与我们的生产,生活息息相关。请根据所学知识回答下列问题:
(1)液氯(Cl2)是自来水厂对天然水进行杀菌消毒的常用物质。在实验室制取氯气的化学方程式为: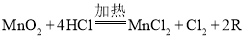 ,R的化学式为_________;实验中MnO2可以用KMnO4、KClO3等物质替代,KMnO4中Mn元素的化合价为________________。
,R的化学式为_________;实验中MnO2可以用KMnO4、KClO3等物质替代,KMnO4中Mn元素的化合价为________________。
(2)“绿水青山就是金山银山”是建设生态文明的重要理念,下列做法与这一理念相符的是_______。
A 为省工省时,就地焚烧农作物秸秆
B 垃圾进行分类回收,实现垃圾变废为宝
C 开发和利用清洁而又高效的新能源
D 大量施用化肥农药,提高农作物的产量
(3)我们摄入的各种食物为生命活动提供物质基础和能量,下列说法正确的是_______。
A 维生素可以从蔬菜、水果等食物中获得
B 人体内缺钙会引起贫血症
C 霉变食物加热后即可食用
D 吸烟和被动吸烟都有害健康
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】瓦斯是矿井中隐形杀手。经资料查询,通常瓦斯气体可能含有CO、CO2、CH4等气体。为确定该气体是否含有这三种气体中的一种成几种, 进行了如下探究:
资料: Ⅰ. ![]() ___________
___________
Ⅱ.氧化钙可以吸收的水分和二氧化碳, NaOH可以吸收氧化碳
Ⅲ.浓硫酸具有吸水性
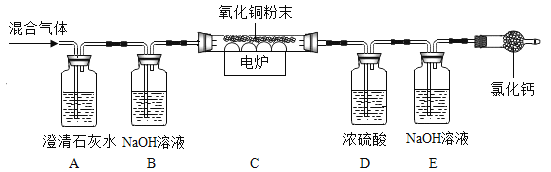
(1)点燃气体后用干冷的烧杯罩住一段时间后, 迅速的倒过来加入澄清石灰水。发现烧杯内壁有水珠,石灰水变浑浊。于是,得出结论该气体是CO、CH4,此结论不严谨的理由是__________。
(2)该装置存在着___________的重大安全隐患。
(3)探究中观察到A中澄清石灰水变浑浊,请写出其化学方程式:____________。
(4)装置中氯化钙的作用是__________。
(5)经过老师的指导改进后,在装置B、 C之间增加了一个浓硫酸装置。加入8g的氧化铜,充分反应后装置E增重m g,则m的取值范围是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。下列说法不正确的是
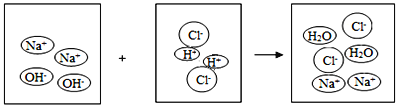
A. 反应前后阴、阳离子的总数目不变
B. 反应前后溶液的总质量不变
C. 反应后溶液呈中性
D. 反应前后元素种类不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com