
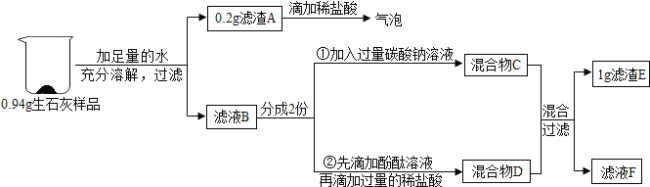
【题目】生石灰常用作食品干燥剂。久置的生石灰里可能会含有氧化钙、氢氧化钙、碳酸钙三种物质中的一种或几种(假设久置的生石灰中不再含有其他成分)。为了探究久置的生石灰的成分,某校化学兴趣小组进行了以下探究活动。
(讨论与分析)
(1)生石灰可以做干燥剂的原因是____(用化学方程式表示);
(2)向0.2g滤渣A中滴加稀盐酸,有气泡产生,说明久置的生石灰样品中一定含有____(填写化学式);
(3)②中反应过程中的实验现象是____;
(4)将混合物C、D全部倒入一个洁净的烧杯中混合,充分反应后,过滤,得到1g滤渣E和红色滤液F。向滤液F中滴加CaCl2溶液,有白色沉淀生成,则滤液F的溶质中一定含有____,还可能含有___;
(解释与结论)(5)依据实验现象和测得的数据判断,0.94g久置的生石灰样品的成分是____。
【答案】CaO+H2O=Ca(OH)2 CaCO3 溶液先变红色,然后逐渐变成无色 碳酸钠和氯化钠 氢氧化钠 Ca(OH)2、CaCO3
【解析】
(1)氧化钙能和水反应生成氢氧化钙,因此氧化钙可以用作干燥剂;
(2)碳酸钙不溶于水,但能和稀盐酸反应生成氯化钙、水和二氧化碳,故滤渣A中有碳酸钙;
(3)氢氧化钙溶液显碱性,能使酚酞试液变红色;氢氧化钙能和稀盐酸反应生成氯化钙和水,产物显中性,不能使酚酞试液变红,且稀盐酸过量也不能使无色酚酞变红,因此,②中反应过程中的实验现象是溶液先变红色,然后逐渐变成无色;
(4)由图可知,加入碳酸钠溶液过量,而且碳酸钠能和氯化钙反应生成白色沉淀碳酸钙和氯化钠,故滤液F的溶质中一定含有碳酸钠和氯化钠,滤液F还可能含有氢氧化钠;
(5)由以上个小问详解可知,0.94g久置的生石灰样品的成分是Ca(OH)2、CaCO3。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:初中化学 来源: 题型:
【题目】实验是进行科学探究的重要方式。请根据下图回答问题。
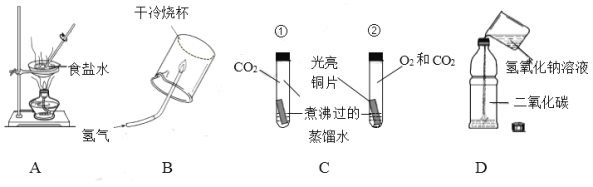
(1)用图A 所示装置蒸发食盐水时,玻璃棒的作用是______。
(2)用图B 所示装置在空气中点燃氢气,该反应的化学方程式为_____。在点燃氢气等可燃性气体前,一定要先_____。
(3)图 C 所示装置是探究铜生锈的部分实验,铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3] 。实验所用铜片形状、大小相同。一段时间后,试管①中铜片保持光亮,试管②中铜片出现绿色锈渍。对比试管①②的实验现象,得出的结论是_____。
(4)甲同学用图D 所示装置探究二氧化碳能否与氢氧化钠发生反应。他向盛满二氧化碳的软塑料瓶中倒入 10%的氢氧化钠溶液 50mL,迅速拧紧瓶盖,振荡,观察到软塑料瓶变瘪。由此得出结论:二氧化碳能与氢氧化钠发生反应。乙同学认为甲同学的实验方案不严谨,理由是_____。乙同学利用图D 所示装置,补做一个对比实验:将甲同学实验中的_____换成_____,实验步骤与甲同学完全相同,对比两个实验的现象得出结论: 二氧化碳能与氢氧化钠发生反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】物质的溶解性受到各种因素的影响,请根据下列信息回答问题:
表一:常温下,一些物质在水中的溶解度
Ba(NO3)2 | BaCl2 | AgCl | AgNO3 | |
水 | 9.2g | 33.3g | 0.00015g | 170.0g |
表二:常温下,一些物质在乙醇中的溶解度
Ba(NO3)2 | BaCl2 | NaOH | NaCl | Ca(NO3)2 | CaCl2 | |
乙醇 | 0.002g | 4.1g | 14.7g | 0.07g | 33.9g | 20.5g |
(1)表一、表二数据说明物质的溶解性受到_____等因素的影响。
(2)常温下,40g水中加入2gBa(NO3)2固体,充分溶解,得到溶液质量为_____g。
(3)酸、碱、盐在溶液中发生复分解反应的条件是有沉淀析出、或有气体放出、或有水生成。请回答
①表一中物质在水中发生复分解反应的化学方程式_____。
②表二中物质在乙醇中发生复分解反应的化学方程式_____。从微观的角度看,溶液中减少的微粒是_____(写微粒符号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列应用、化学方程式及基本反应类型均正确的是( )
A. 鉴别碳酸钠溶液和氯化钠溶液:HCl+Na2CO3=NaCl+H2O+CO2↑ 复分解反应
B. 硫酸厂污水可用熟石灰中和处理:H2SO4+Ca(OH)2=CaSO4+H2O 复分解反应
C. 用红磷测定空气中氧气含量:4P+5O2=2P2O5 氧化反应
D. 生石灰加入到紫色石蕊试液中,石蕊变色的原因:CaO+H2O=Ca(OH)2 化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数,探究过程如下:
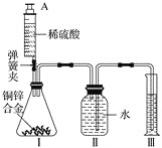
①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量为1.4g
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09gL-1。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为___,实验过程中须加入稀硫酸至不再产生气体,目的是___。
(2)步骤③中称量剩余固体之前的正确操作是_______、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中________(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有________(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积
【答案】(1)![]() ;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
【解析】
试题(1)由于铜排在了氢的后面,所以与酸不反应,反应物是锌和硫酸,生成物是硫酸锌和氢气,氢气后面标上上升符号;实验过程中须加入稀硫酸至不再产生气体,目的是使样品中的锌完全反应;(2)从铜和硫酸锌溶液的混合物中得到铜,先进行过滤,得到带有硫酸锌溶液的铜,再进行洗涤除去表面的硫酸锌,再进行干燥除去水即可;(3)根据加入稀硫酸的量进行计算需要知道稀硫酸的溶质质量分数,而题中没有告知;(4)由于锌与硫酸反应生成硫酸锌和氢气时,放出热量,如果没等冷却到室温,根据热涨冷缩的原理可知进入量筒中水偏多,所以误认为得到的氢气多,再就是数据处理时,未排除加入稀硫酸所占的体积,计算的结果就偏大;
考点:金属的化学性质;化学方程式;实验误差分析;
点评:熟记金属活动性顺序表,知道排在氢之前的金属和稀盐酸或者硫酸反应生成氢气,而排中氢之后的金属和稀盐酸或者稀硫酸不生成氢气;化学反应中物质的质量比都是纯净物之间的质量比,而溶液中溶质的质量=溶液质量×溶质质量分数;本题容易出错的地方是对实验结果的评价,要知道锌与硫酸反应放出热量,会造成相应的误差,必须冷却到室温才能进行观察和计算。
【题型】实验题
【结束】
30
【题目】用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列化学实验装置,回答有关问题。
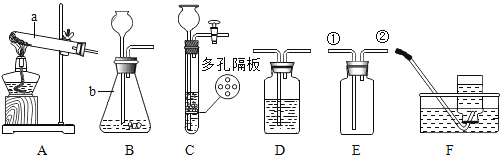
(1)写出图中标有字母的仪器的名称:a_________,b________。
(2)实验室用氯酸钾制取氧气时应选择________(填代号)作为发生装置。常温下,下列收集氧气的方法不可行的是_______(填字母序号a.向上排空气法b.向下排空气法c.排水法)
(3)用装置E收集实验室制取的二氧化碳,气体应从________(填“①”或“②”)端进入。
(4)实验室常用装置C代替装置B制取气体,装置C的优点是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用氨碱法制纯碱,制取过程如下:
![]()
(1)上图中①是_____。
(2)上述制取过程中的化学反应原理(用化学方程式)为_____。
(3)制取过程中先向饱和食盐水中通入较多的氨气,再通入足量的二氧化碳,其原因是:_____。
(4)但工业上不能用氨碱法制取碳酸钾,只是因为在溶液中_____。
A KHCO3溶解度较大
B KHCO3溶解度较小
C K2CO3溶解度较大
D K2CO3溶解度较小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语填空:
![]() 镁______;
镁______;
![]() 个氮气分子______;
个氮气分子______;
![]() 个氢原子______;
个氢原子______;
![]() 价的硫元素______;
价的硫元素______;
![]() 氢氧化铁______;
氢氧化铁______;
![]() 缺少______元素会得佝偻病;
缺少______元素会得佝偻病;
![]() 个二氧化碳分子______;
个二氧化碳分子______;
![]() 个硫酸根离子______;
个硫酸根离子______;
![]() 个铵根离子______;
个铵根离子______;
![]() 相对分子质量最小的氧化物______。
相对分子质量最小的氧化物______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON)。请你根据丙烯酰胺(C3H5ON)的化学式计算后填写:
(1)丙烯酰胺(C3H5ON)的相对分子质量为_______________;
(2) 丙烯酰胺分子中C、H、O、N的原子个数比为 ____________ ;
(3)碳元素和氧元素的质量比是________;
(4)氢元素的质量分数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com