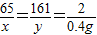15g锌铜的混合物,与100g稀硫酸恰好完全反应,生成氢气0.4g.求:
(1)混合物中含铜多少克?
(2)反应后所的溶液中溶质的质量?
【答案】
分析:(1)根据金属的活动性锌>氢>铜,锌铜混合物中铜不能与稀硫酸反应放出氢气,可以据此结合锌和稀硫酸反应的化学方程式进行计算参加反应锌的质量;
(2)根据锌与硫酸反应的化学方程式,由生成氢气的质量可计算恰好完全反应时生成硫酸锌的质量.
解答:解:设生成0.4g氢气消耗锌的质量为x,反应后生成硫酸锌的质量为y,
Zn+H
2SO
4═ZnSO
4+H
2↑
65 161 2
x y 0.4g
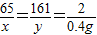
解得:x=13g.g,y=32.2g
混合物中含铜为:15g-13g=2g;
答:(1)混合物中含铜2克;
(2)反应后所的溶液中溶质的质量为32.2g.
点评:根据化学方程式可以表示反应中各物质的质量关系,由反应中一种物质的质量可计算出反应中其它物质的质量.