
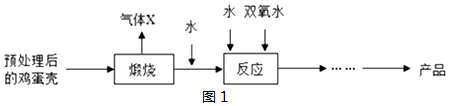
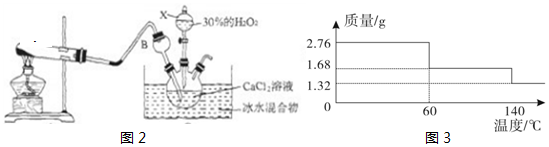
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)由于气体X是高温煅烧碳酸钙得到,所以气体X是 二氧化碳,两次加水发生的都是化合反应,其一是氧化钙和水反应生成氢氧化钙,其二是氧化钙和过氧化氢以及水反应生成CaO2.8H2O,对应的化学方程式依次为:CaO+H2O═Ca(OH)2,CaO+H2O2+7H2O═CaO2.8H2O.由于过程中氧化钙遇到了水生成氢氧化钙,所以 CaO2•8H2O实际获得的产品不纯,主要含有的固体杂质是 Ca(OH)2.
(2)装置A加热的是熟石灰和硫酸铵,生成硫酸钙和氨气以及水,对应的化学方程式 Ca(OH)2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2NH3↑+2H2O.
(3)制取CaO2•8H2O的化学方程式:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O+2Y.根据质量守恒定律可得,Y的化学式 NH4Cl.该反应一般在0~5℃的低温下进行,由于过程中加入了氨水,氨水是氨气溶解于水形成的溶液,所以温度升高会导致气体溶解度降低而挥发出来,所以温度不能过高的原因是氨水受热会加剧挥发.
(4)产品性质测定:甲组取产品充分加热,由于信息提示为“加热至350℃左右,过氧化钙迅速分解,生成氧化钙,并放出氧气”,而检验氧气一般使用带火星的木条,所以可用带火星的木条检验产生的气体.乙组取产品加水,根据信息提示“过氧化钙与水反应生成氢氧化钙和氧气”,生成物为碱性的氢氧化钙,所以滴入无色酚酞溶液,酚酞变红.由于甲组加热后生成了氧化钙,而氧化钙遇到无色酚酞溶液,能和水反应得到碱性的氢氧化钙,使酚酞变红,所以若需得到同样的结论,甲组能采用与乙组相同的方法.
(5)由图可以看出失去的结晶水的质量为2.76g-1.32g=1.44g.
设样品中CaO2•8H2O的质量为x
CaO2•8H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaO2+8H2O
216 144
x 1.44g
$\frac{216}{144}$=$\frac{x}{1.44g}$
x=2.16g
样品中CaO2•8H2O的质量分数为$\frac{2.16g}{2.76g}$×100%≈78.3%
答:①CaO2•8H2O样品中结晶水的质量=1.44g.
②该样品中CaO2•8H2O的质量分数 78.3%.
(6)
A.由于甲组实验中生成二氧化碳气体,之后的反应中没有二氧化碳的参与,所以甲组反应的原子利用率不是100%.错误;
B.在原料充分转化的前提下,由于甲组中生成了氢氧化钙等杂质,所以甲组的CaO2•8H2O沉淀过滤后需要洗涤.错误;
C.乙组产生的副产品氯化氢由于会和产品反应,所以可能会影响CaO2的产率.正确.
故选:C.
故答案为:
【进行实验】
(1)二氧化碳;CaO+H2O═Ca(OH)2; CaO+H2O2+7H2O═CaO2.8H2O; Ca(OH)2.
(2)Ca(OH)2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2NH3↑+2H2O.
(3)NH4Cl;氨水受热会加剧挥发.
(4)带火星的木条;能.
(5)①1.44.
②78.3%;
(6)C.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:初中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①④⑤⑥ | C. | ③⑤⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化
稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲>乙>丙>丁 | B. | 乙>甲>丙>丁 | C. | 丁>丙>乙>甲 | D. | 乙>甲>丁>丙 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
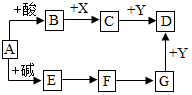 如图是初中化学常见物之间的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态,试回答下列问题:
如图是初中化学常见物之间的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com