
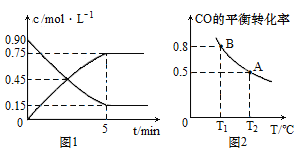
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌдкШ§ИіЬхЛ§ОљЮЊ0.5 LЕФКуШнУмБеШнЦїжаЗЂЩњЗДгІЃКCO(g)+Cl2(g) ![]() COCl2(g)ЃЌЦфжаШнЦїЂёжаЗДгІдк5 minЪБДяЕНЦНКтзДЬЌЁЃ
COCl2(g)ЃЌЦфжаШнЦїЂёжаЗДгІдк5 minЪБДяЕНЦНКтзДЬЌЁЃ
ШнЦїБрКХ | ЮТЖШ/Ёц | Ц№ЪМЮяжЪЕФСП/mol | ЦНКтЮяжЪЕФСП/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ђё | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ђђ | 500 | 1.0 | a | 0 | 0.5 |
Ђѓ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
ЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A.ИУЗДгІе§ЗДгІЮЊЗХШШЗДгІ
B.ШнЦїЂёжаЧА5 minЕФЦНОљЗДгІЫйТЪІд(CO)=0.16 molЁЄL-1ЁЄmin-1
C.ШнЦїЂђжаЃЌaЃН0.55 mol
D.ШєШнЦїЂёЮЊКубЙЃЌДяЕНЦНКтЪБCOзЊЛЏТЪаЁгк80%
ЁОД№АИЁПAC
ЁОНтЮіЁП
A. ШєШнЦїIЁЂIIIЕФЮТЖШЖМЪЧ500ЁцЃЌдђСНепЪЧЭъШЋШЋЕШЕФЕШаЇЦНКтЃЌШнЦїIIIЕФЮТЖШЮЊ600ЁцЃЌЩ§ИпЮТЖШCOCl2ХЈЖШНЕЕЭЃЌЫЕУїЦНКтФцЯђвЦЖЏЃЌЩ§ИпЮТЖШЦНКтЯђЮќШШЗНЯђвЦЖЏЃЌдђе§ЗДгІЪЧЗХШШЗДгІЃЌЙЪAе§ШЗЃЛ
B. IжаЦНКтЪБЕУЕНЁїn(COCl2)=0.8molЃЌИљОнЗНГЬЪНжЊЃЌВЮМгЗДгІЕФЁїn(CO)=Ёїn(COCl2)=0.8molЃЌдђ5minФкІд(CO)= =0.32molL1min1ЃЌЙЪBДэЮѓЃЛ
=0.32molL1min1ЃЌЙЪBДэЮѓЃЛ
C. IжаДяЕНЦНКтзДЬЌЪБЃЌn(CO)=n(Cl2)=1.0mol0.8mol=0.2molЃЌдђЦНКтЪБc(CO)=c(Cl2)=![]() ==0.4mol/LЃЌc(COCl2)=
==0.4mol/LЃЌc(COCl2)= ![]() =1.6mol/LЃЌЛЏбЇЦНКтГЃЪ§K=
=1.6mol/LЃЌЛЏбЇЦНКтГЃЪ§K=![]() ЃЌЮТЖШЯрЭЌЃЌЛЏбЇЦНКтГЃЪ§ЯрЭЌЃЌЫљвдIIжаЛЏбЇЦНКтГЃЪ§K=10ЃЌ
ЃЌЮТЖШЯрЭЌЃЌЛЏбЇЦНКтГЃЪ§ЯрЭЌЃЌЫљвдIIжаЛЏбЇЦНКтГЃЪ§K=10ЃЌ
CO(g)+Cl2(g)COCl2(g)ЃЌ
ГѕЪМЃЈmolЃЉ1.0a0
БфЛЏЃЈmolЃЉ0.50.50.5
ЦНКтЃЈmolЃЉ0.5(a0.5) 0.5
ЦНКтЪБc(CO)=c(COCl2)=![]() =1mol/LЃЌc(Cl2)=
=1mol/LЃЌc(Cl2)= ![]() mol/L=2(a0.5)mol/LЃЌЛЏбЇЦНКтГЃЪ§K=
mol/L=2(a0.5)mol/LЃЌЛЏбЇЦНКтГЃЪ§K=![]() =10ЃЌНтЕУa=0.55ЃЌЙЪCе§ШЗЃЛ
=10ЃЌНтЕУa=0.55ЃЌЙЪCе§ШЗЃЛ
D.КуШнШнЦї IжаМгШы1.0molCOЁЂ1.0molCl2ЪБЃЌCOзЊЛЏТЪ=![]() ЁС100%=80%ЃЌШєШнЦїIЮЊКубЙЃЌЯрЖдгкКуШнШнЦїЃЌдіДѓбЙЧПЦНКте§ЯђвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪДѓгк80%ЃЌЙЪDДэЮѓЃЛ
ЁС100%=80%ЃЌШєШнЦїIЮЊКубЙЃЌЯрЖдгкКуШнШнЦїЃЌдіДѓбЙЧПЦНКте§ЯђвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪДѓгк80%ЃЌЙЪDДэЮѓЃЛ
Д№АИбЁACЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪТЪЕВЛФмгУРеЯФЬиСадРэНтЪЭЕФЪЧ
ЂйвЛбѕЛЏЬМбЯжижаЖОашвЊЗХШыИпбЙбѕВежаЂкЖўбѕЛЏЕЊгыЫФбѕЛЏЖўЕЊЕФЦНКтЬхЯЕЃЌМгбЙЫѕаЁЬхЛ§КѓбеЩЋМгЩюЂлЪЕбщЪвПЩгУХХБЅКЭЪГбЮЫЎЕФЗНЗЈЪеМЏТШЦјЂмздРДЫЎГЇгУвКТШЯћЖОДІРэЪБМгЩйСПвКАБЂнФЦгыТШЛЏМиЙВШкжЦБИNa(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.ЂйЂлB.ЂкC.ЂлЂмD.ЂкЂн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПЧрЭЦїЃЈКЌCuЁЂSnЕШЃЉдкГБЪЊЛЗОГжаЗЂЩњЕФИЏЪДЖдгкЮФЮяБЃЛЄКЭаоИДгаживЊвтвхЁЃЯТЭМЮЊЧрЭЦїдкГБЪЊЛЗОГжаЗЂЩњЕчЛЏбЇИЏЪДЕФдРэЪОвтЭМЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
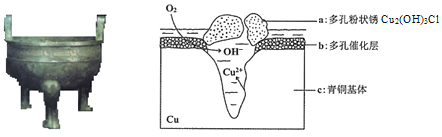
A.ЧрЭЦїЗЂЩњЮќбѕИЏЪДЃЌЭМжаcзїИКМЋЃЌБЛбѕЛЏ
B.е§МЋЗЂЩњЕФЕчМЋЗДгІЮЊO2+ 4eЃ+2H2O=4OHЃ
C.ШєЩњГЩ0.2 mol Cu2(OH)3ClЃЌдђРэТлЩЯЯћКФЕФO2ЬхЛ§ЮЊ4.48L
D.ЛЗОГжаЕФClЃгыЕчМЋВњЮяЩњГЩaЕФРызгЗНГЬЪНЮЊ2Cu2ЃЋ+3OHЃ+ClЃ=Cu2 (OH)3Cl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧВПЗжЖЬжмЦкдЊЫиЛЏКЯМлгыдзгађЪ§ЕФЙиЯЕЭМЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )
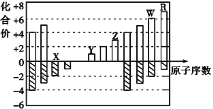
A. ЦјЬЌЧтЛЏЮяЕФЮШЖЈадЃКR>W
B. XгыYПЩвдаЮГЩдзгИіЪ§БШЮЊ1ЁУ1КЭ1ЁУ2ЕФСНжжРызгЛЏКЯЮя
C. гЩXЁЂYЁЂZЁЂWЁЂRЮхжждЊЫиаЮГЩЕФМђЕЅРызгжаАыОЖзюаЁЕФЪЧX2-
D. YКЭZСНепзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяФмЯрЛЅЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЯђNaHCO3ШмвКжаЕЮШыбЮЫсЃЌЛьКЯШмвКЕФpHгыРызгХЈЖШБфЛЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ
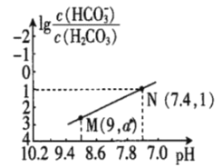
A.25ЁцЪБЃЌH2CO3ЕФвЛМЖЕчРыK(H2CO3)=1.0ЁС10-6.4
B.ЭМжаa=2.6
C.25ЁцЪБЃЌHCO3-+H2O![]() H2CO3+OH-ЕФKh=1.0ЁС10-7.6
H2CO3+OH-ЕФKh=1.0ЁС10-7.6
D.MЕуШмвКжаЃКc(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌФГШмвКжагЩЫЎЕчРыГіЕФc(OH-)=1ЁС10-13mol/LЃЌИУШмвКжавЛЖЈВЛФмДѓСПЙВДцЕФРызгзщЪЧЃЈ ЃЉ
A.NH![]() ЁЂFe3+ЁЂSO
ЁЂFe3+ЁЂSO![]() ЁЂCl-B.CO
ЁЂCl-B.CO![]() ЁЂPO
ЁЂPO![]() ЁЂK+ЁЂNa+
ЁЂK+ЁЂNa+
C.Na+ЁЂSO![]() ЁЂNO
ЁЂNO![]() ЁЂCl-D.HPO
ЁЂCl-D.HPO![]() ЁЂNa+ЁЂHSO
ЁЂNa+ЁЂHSO![]() ЁЂK+
ЁЂK+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзДМЪЧвЛжжживЊЕФПЩдйЩњФмдДЁЃ
ЂёЃЎвбжЊЃК2CH4(g)+O2(g)=2CO(g)+4H2(g) ЁїH=Ѓ70.8 kJЁЄmolЃ1 CO(g)+2H2(g)=CH3OH(g) ЁїH=Ѓ90.5 kJЁЄmolЃ1
аДГігЩCH4КЭO2жЦШЁCH3OH(g)ЕФШШЛЏбЇЗНГЬЪН_____________________ЁЃ
ЂђЃЎЖдгкЗДгІCO(g)+2H2(g)=CH3OH(g)ЃЌЛиД№ЯТСаЮЪЬтЃК
(1)ЭМ1ЪЧCO(g)КЭCH3OH(g)ЮяжЪЕФСПХЈЖШЫцЪБМф(t)ЕФБфЛЏЧњЯпЃЌДгЗДгІПЊЪМжСДяЕНЦНКтЪБЃЌгУH2БэЪОЕФЗДгІЫйТЪІд(H2)=________ЃЌCOЕФзЊЛЏТЪЮЊ_________ЁЃ
(2) дкШнЛ§ЮЊ2LЕФИеадШнЦїжаГфШы5mol COКЭ10mol H2ЃЌЗЂЩњЗДгІВЂДяЕНЦНКтЃЌCOЕФЦНКтзЊЛЏТЪЫцЮТЖШ(T)ЕФБфЛЏЧњЯпШчЭМ2ЫљЪОЁЃ
ЂйМЦЫуBЕуЦНКтГЃЪ§KBЃН______ЃЛДяЕНЦНКтЪБЃЌШєдйГфШы2mol COЁЂ4mol H2КЭ2mol CH3OHЃЌЗДгІЯђ__________Нјаа(ЬюЁАе§ЗДгІЗНЯђЁБЛђЁАФцЗДгІЗНЯђЁБ)ЁЃ
ЂкБШНЯKAЁЂKBЕФДѓаЁ________ЁЃ
ЂлФмХаЖЯИУЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ____ЃЈЬюзжФИађКХЃЉЁЃ
AЃЎH2ЕФЬхЛ§ЗжЪ§ВЛдйИФБф
BЃЎH2ЕФЯћКФЫйТЪЕШгкCH3OHЕФЩњГЩЫйТЪЕФ2БЖ
CЃЎH2ЕФзЊЛЏТЪКЭCOЕФзЊЛЏТЪЯрЕШ
DЃЎЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаAЁЂBЁЂCЁЂDЁЂE ЮхжждЊЫиЕФдзгађЪ§вРДЮдіДѓЃЌBЁЂC ЕФбєРызггыAЕФвѕРызгКЭФЪдзгЕФЕчзгВуНсЙЙЯрЭЌЃЛAЁЂBПЩаЮГЩРызгЛЏКЯЮяB2AЃЛCЕФбѕЛЏЮяМШФмгыЧПЫсЗДгІЃЌгжФмгыЧПМюЗДгІЃЛDЕФдзгНсЙЙЪОвтЭМЮЊЃК ЃЛEЕФзюЭтВуЕчзгЪ§ЪЧЕчзгВуЪ§ЕФ2БЖЁЃЪдЛиД№ЯТСаИїЮЪЬтЃК
ЃЛEЕФзюЭтВуЕчзгЪ§ЪЧЕчзгВуЪ§ЕФ2БЖЁЃЪдЛиД№ЯТСаИїЮЪЬтЃК
ЃЈ1ЃЉBЁЂDдЊЫиЗжБ№ЮЊ_________ЁЂ_________ЃЛ
ЃЈ2ЃЉDдЊЫиЮЛгкдЊЫижмЦкБэжаЕк_______жмЦкЁЂЕк______зхЃЛ
ЃЈ3ЃЉЛЏКЯЮяB2AЕФЕчзгЪН____________________ЃЛ
ЃЈ4ЃЉEЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЕФЗжзгЪНЪЧ________________________ЁЃ
ЃЈ5ЃЉDгыNaOHШмвКЗДгІЕФЛЏбЇЗНГЬЪНЃК_______________________________ЁЃ
ЃЈ6ЃЉCЕФбѕЛЏЮягыEЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяШмвКЗДгІЕФРызгЗНГЬЪНЃК ________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЯТЃЌдк2LЕФУмБеШнЦїжаЃЌМгШы1molXЃЈgЃЉКЭ2molYЃЈgЃЉЗЂЩњЗДгІЃКXЃЈgЃЉ+m YЃЈgЃЉ![]() 3ZЃЈgЃЉЃЌЦНКтЪБЃЌXЁЂYЁЂZЕФЬхЛ§ЗжЪ§ЗжБ№ЮЊ30%ЁЂ60%ЁЂ10%ЁЃдкДЫЦНКтЬхЯЕжаМгШы1molZЃЈgЃЉЃЌдйДЮДяЕНЦНКтКѓЃЌXЁЂYЁЂZЕФЬхЛ§ЗжЪ§ВЛБфЁЃЯТСаа№ЪіВЛе§ШЗЕФЪЧ
3ZЃЈgЃЉЃЌЦНКтЪБЃЌXЁЂYЁЂZЕФЬхЛ§ЗжЪ§ЗжБ№ЮЊ30%ЁЂ60%ЁЂ10%ЁЃдкДЫЦНКтЬхЯЕжаМгШы1molZЃЈgЃЉЃЌдйДЮДяЕНЦНКтКѓЃЌXЁЂYЁЂZЕФЬхЛ§ЗжЪ§ВЛБфЁЃЯТСаа№ЪіВЛе§ШЗЕФЪЧ
A. m=2
B. СНДЮЦНКтЕФЦНКтГЃЪ§ЯрЭЌ
C. XгыYЕФЦНКтзЊЛЏТЪжЎБШЮЊ1:1
D. ЕкЖўДЮЦНКтЪБЃЌZЕФХЈЖШЮЊ0.4 molЁЄLЃ1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com