
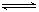 N2O4����H��O�����ܱ������дﵽƽ�⡣ƽ��ʱ�ı����������ʹ��Ӧ�ٴ�ƽ�⣬��ƽ��ʱ��c(NO2)/c(N2O4)��ԭƽ����ȱ���ˣ���ı������Ŀ�����
N2O4����H��O�����ܱ������дﵽƽ�⡣ƽ��ʱ�ı����������ʹ��Ӧ�ٴ�ƽ�⣬��ƽ��ʱ��c(NO2)/c(N2O4)��ԭƽ����ȱ���ˣ���ı������Ŀ�����| A�����������ݻ����¶Ȳ��䣬�������ڲ�����NO2 |
| B����������ѹǿ���¶Ȳ��䣬�������ڲ�����N2O4 |
| C�����������ݻ����¶Ȳ��䣬�������ڲ�����N2 |
| D�������������ݻ����䣬�������¶� |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊ
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊ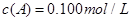 ��
��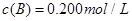 ��
��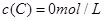 ����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��
����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��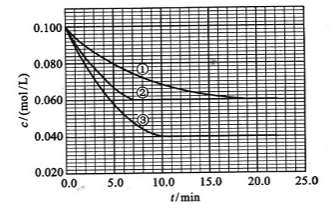
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
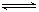 CO2(g)+H2(g) ��H=-43kJ/mol����850��ʱ��K=1������ij�ܱ������г���1.0molCO��3.0molH2O��1.0molCO2��xmolH2������˵������ȷ���ǣ� ��
CO2(g)+H2(g) ��H=-43kJ/mol����850��ʱ��K=1������ij�ܱ������г���1.0molCO��3.0molH2O��1.0molCO2��xmolH2������˵������ȷ���ǣ� ��A��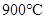 ���÷�Ӧ��ƽ�ⳣ�� ���÷�Ӧ��ƽ�ⳣ��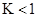 |
B��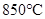 �ﵽƽ��ʱ��ͨ��CO��COת���ʽ����� �ﵽƽ��ʱ��ͨ��CO��COת���ʽ����� |
C��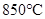 ʱ���� ʱ����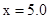 ������ʼʱƽ�����淴Ӧ�����ƶ� ������ʼʱƽ�����淴Ӧ�����ƶ� |
D��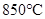 ʱ����Ҫʹ������Ӧ��ʼʱ������Ӧ������У��� ʱ����Ҫʹ������Ӧ��ʼʱ������Ӧ������У���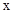 Ӧ���� Ӧ����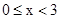 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO(g)��O2(g) ��H>0�������ֲ�ͬ�����½��У�����NO��O2����ʼŨ�ȶ�Ϊ0 mol/L��ʵ���Ӧ�¶���ͬ��NO2��Ũ��(mol��L��1)��ʱ��(min)�ı仯��ͼ��ʾ��
2NO(g)��O2(g) ��H>0�������ֲ�ͬ�����½��У�����NO��O2����ʼŨ�ȶ�Ϊ0 mol/L��ʵ���Ӧ�¶���ͬ��NO2��Ũ��(mol��L��1)��ʱ��(min)�ı仯��ͼ��ʾ��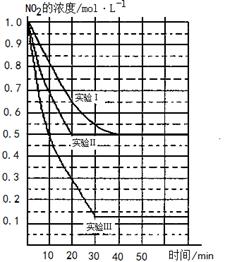
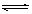 SO3(g)��NO(g) ��H>0����NO2��SO2�������
SO3(g)��NO(g) ��H>0����NO2��SO2�������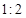 �����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ���� ��
�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ���� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
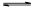 2NH3(g)��CO2(g)��
2NH3(g)��CO2(g)��| �¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹǿ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ��(��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
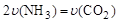 B���ܱ���������ѹǿ����
B���ܱ���������ѹǿ���� NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��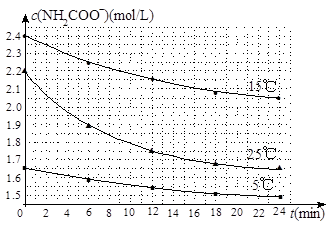
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��2AB(g)�ﵽƽ��״̬�ı�־�ǣ� ��
��2AB(g)�ﵽƽ��״̬�ı�־�ǣ� ��| A����λʱ��������n mol A2��ͬʱ������n mol��AB |
| B�������ڵ���ѹǿ����ʱ����仯 |
| C����λʱ��������2n mol AB��ͬʱ������n mol��B2 |
| D����λʱ���ڣ�����n mol A2��ͬʱ������n mol��B2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H+ + In-����ɫ����H��0������ƽ����Ͳ���ȷ����
H+ + In-����ɫ����H��0������ƽ����Ͳ���ȷ����| A�������¶�ƽ�����������ƶ� |
| B�����������ƽ�����淽���ƶ�����Һ�Ժ�ɫ |
| C������NaOH��Һ��ƽ�����������ƶ�����Һ�Ի�ɫ |
| D������NaHSO4��Һ��ƽ�����������ƶ�����Һ�Ի�ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)�������жϴﵽ��ѧƽ��״̬����
2C(g)�������жϴﵽ��ѧƽ��״̬����| A����ϵѹǿ���� | B����λʱ������n molA,ͬʱ����2nmolC |
| C��A��ת���ʲ��� | D�������������ܶȲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Na2S(s)+4H2O(g)����H<0���ں��º���ʱ�ش��������⣺
Na2S(s)+4H2O(g)����H<0���ں��º���ʱ�ش��������⣺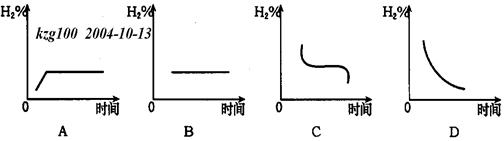
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com