
将0.04 mol KMnO4固体加热,一段时间后,收集到a mol气体,此时KMnO4的分解率为x。在反应后的残留固体中加入足量的浓盐酸,又收集到b mol气体(设Mn元素全部以Mn2+存在于溶液中)。试填写:
(1)a+b=________(用x表示);
(2)当x=________,a+b取最小值且为________;
(3)当a+b=0.09 mol时,加热后所得残留固体的质量为________g。
科目:高中化学 来源:2010年福建省季延中学高二下学期期末考试化学试题 题型:填空题
(8分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
向其中加入少量KOH溶液时,发生反应的离子方程是
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH 溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN?)(填“<”“=”“>”)
②若HA为CH3COOH ,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省黄冈市高三4月调研考试理综化学试卷(解析版) 题型:填空题
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)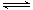 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
(1)已知:① CH4(g)+3/2 O2(g)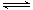 CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g)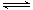 H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g)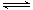 CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,
则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____
KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,
则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____
KB
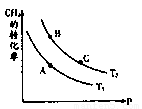
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
查看答案和解析>>
科目:高中化学 来源:2010年福建省高二下学期期末考试化学试题 题型:填空题
(8分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
向其中加入少量KOH溶液时,发生反应的离子方程是
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH 溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN−)(填“<”“=”“>”)
②若HA为CH3COOH ,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源:河南省模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
向其中加入少量KOH溶液时,发生反应的离子方程是
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH 溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN??)(填“<”“=”“>”)
②若HA为CH3COOH ,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com