
|
ǿ���ǿ����ϡ��Һ�е��к��ȿɱ�ʾΪH+(aq)��OH��(aq) HNO3(aq)��KOH(aq) | |
A�� |
Q1��Q2��Q3 |
B�� |
Q2��Q1��Q3 |
C�� |
Q2��Q3��Q1 |
D�� |
Q2��Q3��Q1 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| A��Q1=Q2=Q3 |
| B��Q2��Q3��Q1 |
| C��Q2��Q1��Q3 |
| D��Q2=Q3��Q1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| A����H1=��H2=��H3 |
| B����H2����H1����H3 |
| C����H1����H3����H2 |
| D����H2=��H3����H1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��ǿ���ǿ����ϡ��Һ�з�����Ӧʱ���к���Ϊ57.3 kJ �� mol��1��101 k Paʱ�����ȼ����Ϊ5518 kJ��mol-1���������Ȼ�ѧ����ʽ��д��ȷ����
A��H++OH��=H2O ��H = ��57.3kJ��mol��1
B��2NaOH(aq)+ H2SO4(aq)= Na2SO4(aq)+2H2O(l) ��H = ��114.6 kJ��mol��1
C��2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(g) ��H = ��11036 kJ��mol��1
D��2C8H18(l) + 25O2(g) = 16CO2(g)+18H2O(l) ��H = ��5518kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���㽭ʡ̨���и߶���ѧ����У����������ѧ�Ծ� ���ͣ�ѡ����
ǿ���ǿ����ϡ��Һ�е��к��ȿɱ�ʾΪ: H+(aq)+OH-(aq)=H2O(l); ��H= -57.3k kJ��mol-1����֪����Һ�з�Ӧ��:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)�� ��H=-Q1kJ��mol-1,
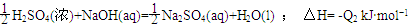
HNO3(aq)+KOH(aq) KNO3��aq��+H2O(l) ; ��H= -Q3 kJ��mol-1��
KNO3��aq��+H2O(l) ; ��H= -Q3 kJ��mol-1��
��Q1��Q2��Q3�Ĺ�ϵ��ȷ����
A. Q1 = Q2 = Q3 B.Q2 > Q1 > Q3 C. Q2 > Q3 > Q1 D. Q2 = Q3 > Q1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com