

| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |



科目:高中化学 来源:不详 题型:问答题
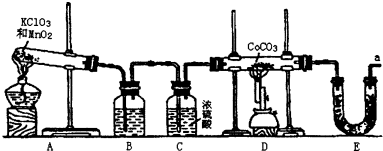
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验课题 | 探究废旧塑料热分解的主要产物为多种烃的混合物 |
| 查阅资料 | ①CuO能将烃氧化成CO2和H2O; ②甲苯可被酸性KMnO4溶液氧化为苯甲酸,苯甲酸能溶于苯。 |
| 实验设计 | 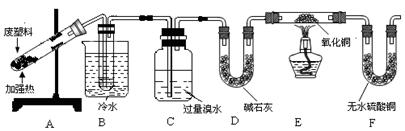  |
| 实验记录 | 按上图连接装置,隔绝空气强热装置A中的试管(忽略装置内空气的影响),一段时间后,可观察到如下现象: ①B装置试管中有液态物质生成; ②C中溴水的颜色变浅; ③E中黑色氧化铜变红; ④F中无水硫酸铜变蓝。 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
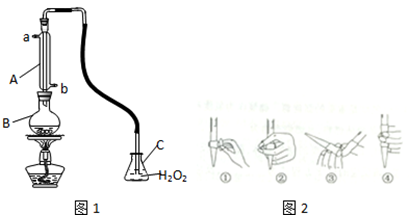
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
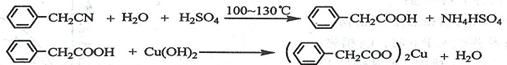
| A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去乙醇的水:加新制生石灰,蒸馏,收集馏出物 |
| B.检验淀粉的水解产物:在用酸作催化剂的水解液中直接加入新制Cu(OH)2溶液,然后加热,观察是否有红色沉淀生成 |
| C.除去乙酸乙酯中的乙酸:加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
| D.银氨溶液的配制:在洁净的试管中加2% AgNO3溶液1~2 mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol·L-1 AgNO3溶液的试管中滴加0.1 mol·L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol·L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 向2 mL甲苯中加入3滴酸性KMnO4溶液,振荡;向2 mL苯中加入3滴酸性KMnO4溶液,振荡 | 证明与苯环相连的甲基易被 氧化 |
| C | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
| D | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 验证淀粉已水解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com