
�����ȷ�Ӧ���Ļ�ѧ����ʽΪ��2Al��Fe2O3 Al2O3��2Fe��ijͬѧ�ԡ����ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ�С������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3���۵㡢�е����ݷֱ����£�
Al2O3��2Fe��ijͬѧ�ԡ����ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ�С������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3���۵㡢�е����ݷֱ����£�
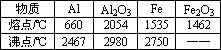
(1)��ͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������Ʋ���һ���ĵ����������ǣ�________��
(2)���һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���________�����۲쵽________����ʱ��˵���������к��н�������
(3)ʵ�����ܽ����������ѡ�������Լ��е�________(ѡ����ĸ���)��
a��Ũ����
b��ϡ����
c��ϡ����
d������������Һ
 �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д� ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1��������һ�ָ�Ч��������Դ��0.25mol������ȫȼ������Һ̬ˮʱ���ų�222.5kJ�����������ȼ���ȵ��Ȼ�ѧ��Ϊ
��1��������һ�ָ�Ч��������Դ��0.25mol������ȫȼ������Һ̬ˮʱ���ų�222.5kJ�����������ȼ���ȵ��Ȼ�ѧ��Ϊ| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ش����¼�������
(1)���ڷ��ֲ���Ҫ�����Դ����ԼˮԴ���ܳ�ȥ��ˮ�е�±����(�а������ཡ��)�ķ������������ں�±����ķ�ˮ�У���һ��ʱ���±���顰��ʧ���������ˮ�е�һ�����龭14.9d��ͼ첻�����ˡ�Ŀǰ��Ϊ��Ӧ��±����(RCH2X)����������д����Ӧʽ��˵��(��ԭ��)��ʧ���ӵĹ�ϵ��
(2) ���NaCl��KCl��AlCl3���������ȵ��Al2O3��Na3AlF6������ʡ����Լ30%��Ϊʲô�����ú�һ�ַ���������
(3) NH4NO3�ȷֽ⼰��ȼ����[��(CH2)n��ʾ]��Ӧ�ķ���ʽ����Ӧ�ȷֱ�Ϊ��
NH4NO3 = N2O + 2H2O + 0.53 kJ/g NH4NO3 ��������(1)
NH4NO3 = N2 + 1/2 O2 + 2H2O + 1.47 kJ/g NH4NO3 ������(2)
3n NH4NO3 + (CH2)n = 3n N2 + 7n H2O + n CO2
+ 4.29n kJ/g NH4NO3 ����(3)
���ʣ������������Ȼ�ѧ����ʽ�ɵó���Щ�µ��Ȼ�ѧ����ʽ?
(4) ����ˮ��Һ��ѧ��Ӧ��֪ʶ�ش���������⣺��Һ̬BrF3����KBrF4�ζ�Br2PbF10�������г��ֵ絼��͵㡣д���йط�Ӧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013�꽭���Ͼ�ѧ�����ר��ѧУ�߶�9���²����ƻ�ѧ�Ծ����������� ���ͣ������
��12�֣�ijͬѧ�ԡ����ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ�С������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
| ���� | Al | Al2O3 | Fe | Fe2O3 |
| �۵�/�� | 660 | 2054 | 1535 | 1462 |
| �е�/�� | 2467 | 2980 | 2750 | -- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭���Ͼ�ѧ�����ר��ѧУ�߶�9���²����ƻ�ѧ�Ծ��������棩 ���ͣ������
��12�֣�ijͬѧ�ԡ����ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ�С������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
|
���� |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
�۵�/�� |
660 |
2054 |
1535 |
1462 |
|
�е�/�� |
2467 |
2980 |
2750 |
-- |
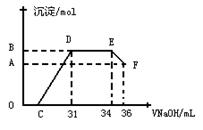
I.��ͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ��������һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ��� ����Ӧ�����ӷ���ʽΪ ��
��. ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4mol��L��1������������Һ����������������Һ�����(mL)������ij��������ʵ���(mol)�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
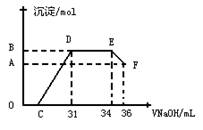
��1��ͼ��OC��û�г������ɣ��˽η�����Ӧ������Ϊ�� ��
��2����DE�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ�Ϊ ��
��3����c=13mLʱ��ԭ��Һ��Fe3+��Al3+�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(15��) �ش����¼�������
(1)���ڷ��ֲ���Ҫ�����Դ����ԼˮԴ���ܳ�ȥ��ˮ�е�±����(�а������ཡ��)�ķ������������ں�±����ķ�ˮ�У���һ��ʱ���±���顰��ʧ���������ˮ�е�һ�����龭14.9d��ͼ첻�����ˡ�Ŀǰ��Ϊ��Ӧ��±����(RCH2X)����������д����Ӧʽ��˵��(��ԭ��)��ʧ���ӵĹ�ϵ��
(2) ���NaCl�DKCl�DAlCl3���������ȵ��Al2O3�DNa3AlF6������ʡ����Լ30%��Ϊʲô�����ú�һ�ַ���������
(3) NH4NO3�ȷֽ⼰��ȼ����[��(CH2)n��ʾ]��Ӧ�ķ���ʽ����Ӧ�ȷֱ�Ϊ��
NH4NO3 = N2O + 2H2O + 0.53 kJ/g NH4NO3 ��������(1)
NH4NO3 = N2 + 1/2 O2 + 2H2O + 1.47 kJ/g NH4NO3 ������(2)
3n NH4NO3 + (CH2)n = 3n N2 + 7n H2O + n CO2 + 4.29n kJ/g NH4NO3 ����(3)
���ʣ������������Ȼ�ѧ����ʽ�ɵó���Щ�µ��Ȼ�ѧ����ʽ?
(4) ����ˮ��Һ��ѧ��Ӧ��֪ʶ�ش���������⣺��Һ̬BrF3����KBrF4�ζ�Br2PbF10�������г��ֵ絼��͵㡣д���йط�Ӧʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com