
【题目】某课外活动小组对采集的酸雨样品进行化验,测得数据如下:c(Na+)=5.0×10-6 mol/L、c(NH4+)=2.0×10-5 mol/L、c(NO3-)=2.0×10-4 mol/L、c(SO42-)=4.0×10-4 mol/L,H+和OH-浓度未测定,则此酸雨的pH约为
A.3 B.4 C.5 D.6
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】聚合氯化铝([Al2( OH)nCl6-n]m}是一种新型高效净水剂,与一般絮凝剂相比,它的吸附能力强、絮凝率高,可由AlCl3经水解法制得。回答下列问题:
(1)工业上可用Cl2、Al2O3和焦炭在高温下反应制取AlCl3![]()
已知:4Al(s)+3O2(g)=2Al2O3(s) △H1
2C(s)+O2(g)=2CO(g) △H2
2Al(s)+3Cl2(g)=2A1Cl3(g) △H3
①Al2O3(s)+3C(s)+3Cl2(g) ![]() 2AlCl3(g)+3CO(g) △H=____________________。
2AlCl3(g)+3CO(g) △H=____________________。
②反应3A12O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
(2)AlCl3在水溶液中分三步水解
Al3++H2O![]() Al(OH)2++H+ K1
Al(OH)2++H+ K1
Al(OH)2++H2O![]() Al(OH)2++H+ K2
Al(OH)2++H+ K2
Al(OH)2++ H2O![]() Al(OH)3+H+ K3
Al(OH)3+H+ K3
①K1、K2、K3由小到大的顺序是_______________________。
②控制溶液的pH在一定范围内,上述水解产物才能聚合生成聚合氯化铝。pH偏小时,Al3+的水解程度弱;pH偏大时的影响是___________________________。
(3)已知有如下可逆反应: ![]()
![]()
298K时,将1mL 1 mol·L-1 AlCl3溶液与1mL2 a mol ·L-1H2QSI溶液混合发生上述反应,溶液中c[Al(HQSI)2+]与时间(t)的关系如图所示。
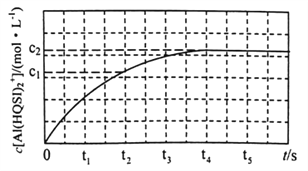
①下列可判断该反应达到平衡状态的是______________(填标号)。![]()
A.溶液的pH不再变化 B. v(Al3+)=v [Al(HQSI)2+]
C.溶液颜色不再变化 D.c(A13+)/c(H2QSI)不再变化
②0~t2时间内,该反应的平均反应速率v(H2QSI)= _________________。
③298K时,该反应的平衡常数K=_________________。
(4)该方法制得的聚合氯化铝的优点是不含其它金属离子,但盐基度低(盐基度:衡量絮凝剂絮凝效果的重要指标,定义式为:盐基度=n(OH)/3n(Al),n为物质的量)。常温下实验测量样品的盐基度,取m g样品,该样品中Al的质量分数为w;加入煮沸后冷却的蒸馏水溶解,配成1L溶液,测得该溶液pH=9.0。则其盐基度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为10 L的恒容密闭容器中充入2 mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。当反应进行10分钟时达到平衡状态,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应进行10分钟时达到平衡状态,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)SO2的转化率为______________________。
(2)从开始到10分钟,用氧气表示该反应的平均反应速率v(O2)=______________________。
(3)达到平衡时反应放出的热量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.H+、Fe2+、ClO﹣、Na+
B.Na+、H+、SO42﹣、CO32﹣
C.Fe3+、Cl﹣、Br﹣、SCN﹣
D.Al3+、NO3﹣、H+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)△H 已知CH4的转化率与温度、压强的关系如图所示.回答下列问题: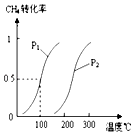
(1)100℃时平衡常数为 .
(2)图中的p1p2(填“<”、“>”或“=”),其理由是:
(3)若100℃时该可逆反应的平衡常数是K1 , 200℃该该可逆反应的平衡常数是K2 , 则K1K2(填“<”、“>”或“=”).其理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量元素,在工农业生产中有广泛应用。回答下列问题:
(1)人工合成的蓝宝石晶体(Al2O3)是目前半导体工业中应用最广泛的材料。
①基态Al原子中有______种运动状态不同的电子,核外电子占据最高能级的符号是_____,占据该能级电子的电子云轮廓图形状为_______。
②比较第一电高能:Mg______Al(填“>”、”<”或“=”)。在现代化学中,常利用_________上的特征谱线来鉴定元素,称为光谱分析。
(2)羰基硫(COS)存在于许多种植物中,杀虫效果显著。
①1molCOS分子中含有σ键的数目为_____,其中心原子的杂化方式为_____。
②CS2、CO2、COS的分解温度由低到高的顺序为_____。
(3)NaCl 和MgO都属于离子化合物.NaC1的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________。
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
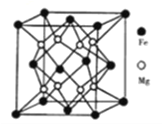
则:①距离一个Fe原子最近的Mg原子个数是______,与此晶胞结构相似的常见的离子晶体是______(填名称)。
②若该晶体储氢时,H2 分子在晶胞的体心和棱心位置,晶胞的参数为dnm,則距离最近的两个H2分子之间的距离为______cm;含铁56g的该储氢合金可储存标准状况下H2 的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应N2+3H2![]() 2NH3,是一个正反应为放热的可逆反应。下列说法正确的是
2NH3,是一个正反应为放热的可逆反应。下列说法正确的是
A. 使用合适的催化剂可以加快反应速率,提高生产效率
B. 生成物的总能量大于反应物的总能量
C. 将该反应设计成原电池,放出的热量不变
D. 达到平衡时,N2的浓度与NH3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( ) 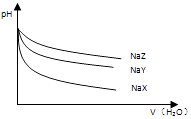
A.在上述三种盐原溶液中,水的电离程度大小是NaX>NaY>NaZ
B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z﹣)>c(Y﹣)>c(X﹣)
C.在上述NaX和NaY的混合液中存在 ![]() =
= ![]()
D.在0.2molL﹣1 NaX溶液中加 入等体积0.1molL﹣1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有化学反应A(g)+B(g)=AB(g)H(反应过程如曲线1所示),当反应体系中加入物质K后反应分两步进行(反应过程如曲线2所示):
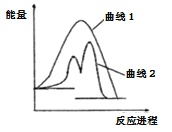
①A(g)+K(g)=AK(g)H1 ②AK(g)+B(g)=AB(g)+K(g)H2,根据图像分析,下列说法正确的是
A. 反应过程中AK(g)是催化剂 B. 加入催化剂会降低反应的H
C. H>0 D. lmolA(g)和1molB(g)的总能量高于1molAB(g)的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com