

(1)玻璃管E内发生反应的化学方程式是________。
(2)小试管C的作用是________。
(3)广口瓶D内盛的试剂是,装置D的3个作用是________。
(4)从管E导出的气体成分是________。
(5)装置F中U形管观察到所收集物质的颜色状态是________。
(6)若U形管内收集到的物质很少,分析其原因不可能是(填标号)________。
A.装置气密性不好;
B.制得的SO2中混有少量H2S杂质使催化剂中毒;
C.气流速度过快
(7)从U形管导出的尾气的处理方法是________。
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:











查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
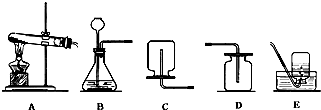 根据下图回答问题.
根据下图回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com