
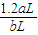 ≥1,
≥1,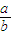 ≥
≥ ;
; +
+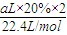 +
+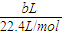 =
=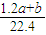 mol,所以2n(Na2CO3)=
mol,所以2n(Na2CO3)=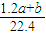 mol,n(Na2CO3)=
mol,n(Na2CO3)=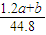 mol,该Na2CO3溶液的物质的量浓度为:
mol,该Na2CO3溶液的物质的量浓度为: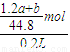 =
=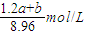 ;
;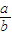 ≥
≥ ;
;  ;
;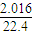 =0.09
=0.09  ×4 (得失电子守恒)
×4 (得失电子守恒) 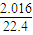 =0.09
=0.09 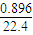 ×4 (得失电子守恒)
×4 (得失电子守恒) 

 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:阅读理解
| a |
| b |
| 5 |
| 6 |
| a |
| b |
| 5 |
| 6 |
| 1.2a +b |
| 8.96 |
| 1.2a +b |
| 8.96 |
| 2.016 |
| 22.4 |
| 0.896 |
| 22.4 |
| 2.016 |
| 22.4 |
| 0.896 |
| 22.4 |
查看答案和解析>>
科目:高中化学 来源:2015届上海市高二上学期期中考试化学试卷(解析版) 题型:填空题
在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2
是_______mol;生成的NaNO3是_______mol 。
(2)NO和NO2的混合气体的组成可表示为NOX ,该混合气体通入NaOH溶液被
完全吸收时,x的值可以为 (填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(3)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
请写出纯碱溶液吸收NO2的化学方程式:____________________
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为: ;该Na2CO3溶液的物质的量浓度为 ________mol/L(用含a、b的代数式表示)。
(5)若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:长宁区二模 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com