
甲同学在0.5mol/L的FeCl3溶液中滴加0.1mol/LKI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫色。乙同学在0.5mol/L的FeCl3溶液中先加入4mol/LNH4F溶液,发现FeCl3溶液渐渐褪至无色,而后再加入0.1mol/LKI溶液,不呈红棕色,再加CCl4振荡,静置,也观察不到CCl4层有紫红色出现。
(1)甲同学的实验说明FeCl3溶液和KI溶液发生的反应,用离子方程式表示_________________。
(2)乙同学在实验中观察不到甲同学的实验现象,其原因分析合理的是_____。
A.Fe3+被F-还原成Fe2+,使溶液中不再存在Fe3+
B.Fe3+与F-结合成难电离物质,不再和I-反应
C.I-和F-或I-与NH4+结合成难电离物质,不再和Fe3+反应
(3)乙同学所用的NH4F溶液是用塑料瓶盛装的,可否改用玻璃试剂瓶_____(填写能与否)其原因是__________ ____。
(共12分)(1)2Fe3++2I-==2Fe2++I2(2)B
(3)不可以;NH4F溶液水解生成HF,NH4++F-+H2O
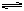 NH3·H2O+HF,氢氟酸会腐蚀玻璃
NH3·H2O+HF,氢氟酸会腐蚀玻璃
【解析】
试题分析:(1)氯化铁具有氧化性,能把碘化钾氧化生成单质碘,反应的离子方程式是2Fe3++2I-==2Fe2++I2。
(2)乙同学观察不到相同的实验现象,说明溶液中并没有发生甲中的反应,即溶液中不存在铁离子,这说明Fe3+与F-结合成难电离物质,不再和I-反应,所以正确的答案选B。
(3)因为NH4F溶液水解生成HF,NH4++F-+H2O
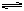 NH3·H2O+HF,氢氟酸会腐蚀玻璃,所以不能用玻璃瓶盛装。
NH3·H2O+HF,氢氟酸会腐蚀玻璃,所以不能用玻璃瓶盛装。
考点:考查离子方程式的首先、盐类水解的判断和应用以及试剂的保存
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和解题方法的指导与训练,有利于培养学生的逻辑思维能力和创新思维能力,提高学生灵活运用基础知识解决实际问题的能力。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
(共16分)甲同学在0.5mol/L的FeCl3溶液中滴加0.1mol/LKI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫色。乙同学在0.5mol/L的FeCl3溶液中先加入4mol/LNH4F溶液,发现FeCl3溶液渐渐褪至无色,而后再加入0.1mol/LKI溶液,不呈红棕色,再加CCl4振荡,静置,也观察不到CCl4层有紫红色出现。
(1)甲同学的实验说明FeCl3溶液和KI溶液发生的反应,用离子方程式表示__________。
(2)乙同学在实验中观察不到甲同学的实验现象,其原因分析合理的是_____。
A.Fe3+被F-还原成Fe2+,使溶液中不再存在Fe3+
B.Fe3+与F-结合成难电离物质,不再和I-反应
C.I-和F-或I-与NH4+结合成难电离物质,不再和Fe3+反应
(3)乙同学所用的NH4F溶液是用塑料瓶盛装的,可否改用玻璃试剂瓶_____(填写能与否)其原因是
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省临沂市高二(上)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com