
(8分)碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大 的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E20和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大 的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E20和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示.请回答下列问题.
(1)E元素原子基态时的电子排布式为 .
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因主要是 ,
 (4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 molC60分子中σ键的数目为 .
(4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 molC60分子中σ键的数目为 .
(5)多元化合物薄膜太阳能电池材料为无机盐,其主要包括
砷化镓、硫化镉、硫化锌及铜铟硒薄膜电池等.
①第一电离能:As Se(填“>”“<”或“=”).
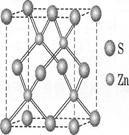
②硫化锌的晶胞中(结构如下图所示),硫离子的配位数
是 与S距离最近且等距离的S之间的距离为
(密度为ρg/cm3)
③二氧化硒分子的空间构型为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com