
| A、a+11 | B、a-5 |
| C、a+3 | D、a+8 |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| ||
| A、析出BaSO3沉淀 |
| B、析出BaSO4沉淀 |
| C、逸出SO3气体 |
| D、逸出SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室从海带提取单质碘的方法依次是:取样、灼烧、溶解、过滤、萃取 |
| B、氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中 |
| C、用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 |
| D、油脂在碱性条件下的水解反应称为油脂的氢化,又称为油脂的硬化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NH4+和H- |
| B、NH5中N元素的化合价为+5价 |
| C、1mol NH5中含有5NA个N-H键 |
| D、与乙醇反应时,NH5被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H2SO4与1mol Ba(OH)2完全中和所放出的热量为中和热 |
| B、能表示氢气燃烧热的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1 |
| C、在101kPa时,1mol碳燃烧所放出的热量一定叫碳的燃烧热 |
| D、CO燃烧是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图①所示装置收集HCl气体 |
| B、用图②所示装置配制一定物质的量浓度的硫酸 |
| C、用图③所示装置检查该装置的气密性 |
| D、用图④所示装置进行实验室制取的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10s | B、大于10s |
| C、小于10s | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
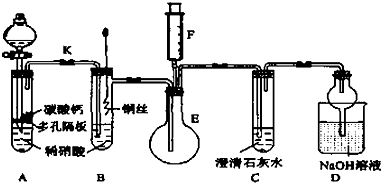
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷与氯气反应制取一氯甲烷 |
| B、乙酸与乙醇反应制取乙酸乙酯 |
| C、苯酚与饱和溴水反应生成三溴苯酚 |
| D、乙烯与氯化氢反应制取氯乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com