
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉-KI试液 | 先变蓝后褪色 | Cl2具有氧化性和漂白性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓氨水、生石灰为固液混合制备氨气,氨气能使湿润的红色石蕊试纸变蓝;
B.浓盐酸、浓硫酸混合时,盐酸易挥发,HCl使湿润的pH试纸变红;
C.浓盐酸、二氧化锰加热可生成氯气,氯气可氧化KI,氯气与水反应生成具有漂白性的HClO;
D.亚硫酸钠、硫酸反应生成二氧化硫,具有漂白性.
解答 解:A.浓氨水、生石灰为固液混合制备氨气,氨气能使湿润的红色石蕊试纸变蓝,NH3为碱性气体,故A正确;
B.浓盐酸、浓硫酸混合时,盐酸易挥发,HCl使湿润的pH试纸变红,则HCl为酸性气体,故B正确;
C.浓盐酸、二氧化锰加热可生成氯气,氯气可氧化KI,氯气与水反应生成具有漂白性的HClO,先变蓝后褪色,但氯气不具有漂白性,故C错误;
D.亚硫酸钠、硫酸反应生成二氧化硫,品红试液褪色,可知具有漂白性,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备实验和性质实验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 上述两个反应中,氧化产物都是H3PO4 | |
| C. | 反应(2)中,1mol CuSO4可氧化1/5molP | |
| D. | 上述两个反应中,氧化剂都只有硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫酸做还原剂,有铜被还原 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 2mol NH4CuSO3完全反应转移6.02×1023个电子 | |
| D. | 刺激性气味的气体是氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| C. | 25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{{r}_{N{a}^{+}}}^{\;}}{{r}_{Na}}$ | B. | $\frac{{r}_{Mg}}{{r}_{Na}}$ | C. | $\frac{{r}_{p}}{{r}_{Cl}}$ | D. | $\frac{{r}_{N}}{{r}_{p}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、天然气、硫酸、醋酸、干冰 | |
| B. | 冰水混合物、胆矾、氯化钾、碳酸、乙醇 | |
| C. | 四氯化碳、硝酸、硫酸钡、二氧化碳、氧气 | |
| D. | 白酒、空气、苛性钠、硫酸、三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
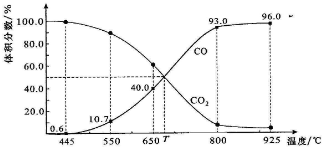
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com