
 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?) (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

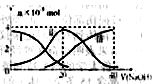
| A.图中五点KW间的关系B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
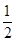 O2(g)═CO(g)△H1=-110.5kJ/mol
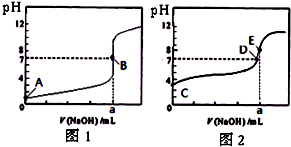
O2(g)═CO(g)△H1=-110.5kJ/mol| A.若碳的燃烧热用△H3表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该NaCl溶液显酸性 | B.该NaCl溶液中Kw=1×10-14 |
| C.该NaCl溶液稀释10倍后pH=7 | D.该NaCl溶液中Kw=1×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)=10.00 mL 时,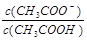 <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com