
电石是重要的工业原料,电石渣[主要成分Ca(OH)2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO2生成CaSO4,反应中的氧化剂是____________ (填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生产过程中,可循环利用的物质有____________ (填化学式)。
(4)用电石渣处理酸性含铬(Cr2O72—)电镀废水的流程如下:

①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr3+的浓度为______(Ksp[Cr(OH)3]=6.3×10—31)。
(15分)(1)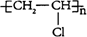 (2分)
(2分)
(2)氧气(2分)
(3)NH3、CO2、H2O(各1分,共3分)
(4)①2SO2+Na2CO3+H2O=2NaHSO3+CO2(3分)
②3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O(3分)
③6.3×10—13molL(漏写单位扣1分,共2分)
【解析】
试题分析:(1)略;(2)电石渣的主要成分是氢氧化钙、碳酸钙等,SO2被吸收后变为亚硫酸钙,然后被空气中的氧气氧化为硫酸钙;(3)碳酸钙热分解生成CaO、CO2,CaO与水反应生成Ca(OH)2,共四步反应中,NH3、CO2、H2O可以循环利用;(4)①亚硫酸的酸性比碳酸强,则吸气步骤反应式为2SO2+Na2CO3+H2O=2NaHSO3+CO2;根据电子、电荷、原子守恒可知,还原步骤反应式为3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O;常温下pH=8,则c(OH—)=Kw/c(H+)=10—6mol/L,Cr(OH)3(s) Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)•c3(OH—)=6.3×10—31,则c(Cr3+)=6.3×10—13mol/L。
Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)•c3(OH—)=6.3×10—31,则c(Cr3+)=6.3×10—13mol/L。
考点:考查结构简式的书写、氧化剂、绿色化学理念、化学方程式、离子方程式、溶度积的计算等相关知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:


| ||

查看答案和解析>>
科目:高中化学 来源:2011-2012年云南省高二上学期期中联考化学试卷(理科) 题型:填空题
(12分)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式1
2 。
(2)为了减缓电石与水的反应速率,实验时常用 代替水。
(3)乙同学推测此乙炔中含有杂质气体H2S,实验时,常用硫酸铜溶液除去该杂质气体,写出相应的化学方程式 。
(4)乙炔是重要的化工材料,常见的塑料聚氯乙烯(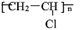 )就是以乙炔为原材料制得的。写出以乙炔和HCl为原料制聚氯乙烯的化学方程式。
)就是以乙炔为原材料制得的。写出以乙炔和HCl为原料制聚氯乙烯的化学方程式。
(1) ,(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式1
2 。
(2)为了减缓电石与水的反应速率,实验时常用 代替水。
(3)乙同学推测此乙炔中含有杂质气体H2S,实验时,常用硫酸铜溶液除去该杂质气体,写出相应的化学方程式 。
(4)乙炔是重要的化工材料,常见的塑料聚氯乙烯()就是以乙炔为原材料制得的。写出以乙炔和HCl为原料制聚氯乙烯的化学方程式。
(1) ,(2)
查看答案和解析>>
科目:高中化学 来源:2011-2012年云南省昆明三中、滇池中学高二上学期期中联考化学试卷(理科) 题型:填空题
(12分)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式1
2 。
(2)为了减缓电石与水的反应速率,实验时常用 代替水。
(3)乙同学推测此乙炔中含有杂质气体H2S,实验时,常用硫酸铜溶液除去该杂质气体,写出相应的化学方程式  。
。
(4)乙炔是重要的化工材料,常见的塑料聚氯乙烯(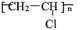 )就是以乙炔为原材料制得的。写出以乙炔和HCl为原料制聚氯乙烯的化学方程式。
)就是以乙炔为原材料制得的。写出以乙炔和HCl为原料制聚氯乙烯的化学方程式。
(1) ,(2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com