
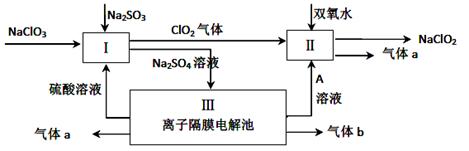
��Դ����������������ٵ��ش���⣬�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ�����о��״�������Ҫ���塣
��1����CO�ϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)  CH3OH(g)���ݻ�Ϊ1L�����ܱ������зֱ����1molCO��2molH2��ʵ���ü״������ʵ������¶ȡ�ʱ��Ĺ�ϵ������ͼ��ʾ���������Ӧ�ġ�H_______0�����������������=�������жϵ�������______��
CH3OH(g)���ݻ�Ϊ1L�����ܱ������зֱ����1molCO��2molH2��ʵ���ü״������ʵ������¶ȡ�ʱ��Ĺ�ϵ������ͼ��ʾ���������Ӧ�ġ�H_______0�����������������=�������жϵ�������______��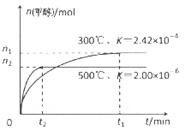
��2�����ù�ҵ�����е�CO2����ȡ�״����䷴ӦΪ��CO2+3H2 CH3OH+H2O��
CH3OH+H2O��
�ٳ��³�ѹ����֪���з�Ӧ�������仯����ͼ��ʾ��
�ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽΪ_______��
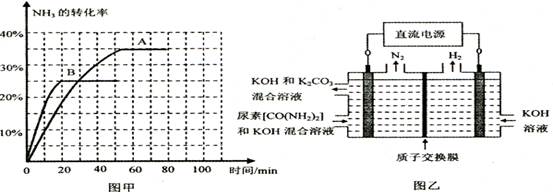
��Ϊ̽����CO2����ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺��һ���º����ܱ������У�����1molCO2��3molH2������������Ӧ�����CO2����CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬v(H2)="_______" �����¶��µ�ƽ�ⳣ����ֵK=______����ʹƽ����ϵ��n(CH3OH)/n(CO2))����Ĵ�ʩ��_______����дһ������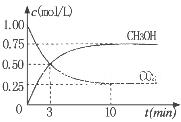
��3����ҵ�����ü״��Ʊ������ij��÷��������֡�
�ټ״���������������Ҫ��ӦΪ��CH3OH(g)  CO(g)+2H2(g)�����ݻ�Ϊ2.0L���ܱ������г���0. 60 molCH3OH(g)����ϵѹǿΪP1����һ�������´ﵽƽ��ʱ����ϵѹǿΪP2����P2/P1 =2.2�����������CH3OH ��ƽ��ת����Ϊ______ ��
CO(g)+2H2(g)�����ݻ�Ϊ2.0L���ܱ������г���0. 60 molCH3OH(g)����ϵѹǿΪP1����һ�������´ﵽƽ��ʱ����ϵѹǿΪP2����P2/P1 =2.2�����������CH3OH ��ƽ��ת����Ϊ______ ��
�ڼ״���������������һ���¶�����Ag/CeO2��ZnOΪ����ʱԭ���������Է�Ӧ��ѡ���ԣ�ѡ����Խ��ʾ���ɵĸ�����Խ�ࣩӰ���ϵ��ͼ��ʾ����n(O2)��n(CH3OH) =0.25ʱ��CH3OH��O2��������Ҫ��Ӧ����ʽΪ______ �����Ʊ�H2��ʱ��ÿ���n(O2))/n(CH3OH)=______��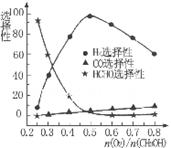
��1�����¶����ߣ�ƽ��ʱ�״��������٣�ƽ�������ƶ���������Ӧ���ȣ����¶����ߣ�ƽ�ⳣ����С��ƽ�������ƶ���������Ӧ���ȣ�����2���� CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ��H="-50KJ/mol." ��0.225mol/(L��min) 5.3 �����¶ȣ����ѹ������H2������H2O��������ϵ�з���ȣ�����3�� ��60�� ��2CH3OH+O2 ="2HCHO+" 2H2O 0. 5
���������������1������Ӧ�ﵽƽ������������¶ȣ�n(CH3OH)��С��ƽ��ʱCH3OH�ĺ������ͣ�˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ���������ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ���ʡ�H��0.��2�� ����ͼһ��֪��CO2(g)+H2(g)=CO(g)+H2O(l) ��H="41KJ/mol," ��ͼ����֪��CO(g)+2H2(g)  CH3OH(g) ��H= -91KJ/mol.����ʽ��ӿɵã�CO2(g) +3H2(g)=CH3OH(l)+H2O(l) ��H="-50KJ/mol." �� V(CO2)=" (1.00-0.25)" mol/L��10min=" 0.075mol/(l��min)." V(H2):V(CO2)=3:1,����V(H2)="3" V(CO2)=" 0.225mol/(L��min)" . �ڸ��¶��µ�ƽ�ⳣ����ֵ
CH3OH(g) ��H= -91KJ/mol.����ʽ��ӿɵã�CO2(g) +3H2(g)=CH3OH(l)+H2O(l) ��H="-50KJ/mol." �� V(CO2)=" (1.00-0.25)" mol/L��10min=" 0.075mol/(l��min)." V(H2):V(CO2)=3:1,����V(H2)="3" V(CO2)=" 0.225mol/(L��min)" . �ڸ��¶��µ�ƽ�ⳣ����ֵ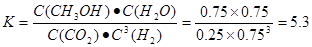 ���ڷ�Ӧ CO2(g) +3H2(g)= CH3OH(l)+H2O(l) ��H=-50KJ/mol.������Ӧ��һ�����ȷ�Ӧ�����Խ����¶���ʹƽ����ϵ��n(CH3OH)/n(CO2)������������ѹ������H2������ˮ�����ӻ�����з�������ȴ�ʩҲ��ʹƽ����ϵ��n(CH3OH)/n(CO2))����3����Ӧ��ʼʱn(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.���跴Ӧ������CH3OH�ı�����ʵ���ΪX����ﵽƽ��ʱ�����ʵ����ʵ���Ϊn(CH3OH)=" (0.6-X)mol," n(CO) ="Xmol" n(H2)=2Xmol,��������̶����ܱ������е����巴Ӧ��˵����Ӧǰ���ѹǿ�ȵ������ǵ����ʵ����ıȡ�����(0.6+2X)��0.6=2.2,���X=0.36.����CH3OH��ƽ��ת����Ϊ0.36��0.6��100��=60��������ͼ��֪��n(O2)��n(CH3OH) =0.25ʱ�õ��IJ����Ǽ�ȩ��CH3OH��O2��������Ҫ��Ӧ����ʽΪ2CH3OH +O2="2HCHO+" 2H2O�����Ʊ�H2ʱ������n(O2)��n(CH3OH) =0.5ʱѡ������ߣ�������ÿ���n(O2))/n(CH3OH)= 0.5��
���ڷ�Ӧ CO2(g) +3H2(g)= CH3OH(l)+H2O(l) ��H=-50KJ/mol.������Ӧ��һ�����ȷ�Ӧ�����Խ����¶���ʹƽ����ϵ��n(CH3OH)/n(CO2)������������ѹ������H2������ˮ�����ӻ�����з�������ȴ�ʩҲ��ʹƽ����ϵ��n(CH3OH)/n(CO2))����3����Ӧ��ʼʱn(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.���跴Ӧ������CH3OH�ı�����ʵ���ΪX����ﵽƽ��ʱ�����ʵ����ʵ���Ϊn(CH3OH)=" (0.6-X)mol," n(CO) ="Xmol" n(H2)=2Xmol,��������̶����ܱ������е����巴Ӧ��˵����Ӧǰ���ѹǿ�ȵ������ǵ����ʵ����ıȡ�����(0.6+2X)��0.6=2.2,���X=0.36.����CH3OH��ƽ��ת����Ϊ0.36��0.6��100��=60��������ͼ��֪��n(O2)��n(CH3OH) =0.25ʱ�õ��IJ����Ǽ�ȩ��CH3OH��O2��������Ҫ��Ӧ����ʽΪ2CH3OH +O2="2HCHO+" 2H2O�����Ʊ�H2ʱ������n(O2)��n(CH3OH) =0.5ʱѡ������ߣ�������ÿ���n(O2))/n(CH3OH)= 0.5��
���㣺������ڼ״�ȼ�ϵ�صĻ�ѧ��Ӧԭ�����Ʒ���֪ʶ��


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��-��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��.SO2+2H2O+I2=H2SO4+2HI
��.2HI H2��+I2
H2��+I2
��.2H2SO4=2SO2+O2��+2H2O
(1)����������Ӧ�������ж���ȷ���� ��
a.��Ӧ�����ڳ����½���
b.��Ӧ����SO2�����Ա�HIǿ
c.ѭ���������貹��H2O
d.ѭ�������в���1 mol O2��ͬʱ����1 mol H2
(2)һ���¶��£���1 L�ܱ������м���1 mol HI(g)��������Ӧ��H2�����ʵ�����ʱ��ı仯��ͼ��ʾ��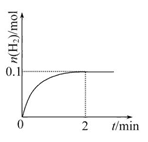
��0��2 min�ڵ�ƽ����Ӧ����v(HI)= ��
����ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������ ��ԭ����2����
a.HI��ƽ��Ũ��
b.�ﵽƽ���ʱ��
c.ƽ��ʱH2���������
(3)ʵ������Zn��ϡ������ȡH2���������������й����Լ��е� ������H2�����ʽ�����
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij��ȤС��̽����â��Na2SO4��10H2O��CaOΪԭ���Ʊ�Na2CO3��
��1����CaOˮ������â���γ�Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ����Ӧ����ˣ�����Һ��ͨ��CO2�������õ�Na2CO3����Ԫ��ϵ�з�Ӧ�����ӷ���ʽΪ�� SO42��+ Ca(OH)2(s)+2H2O CaSO4��2H2O(s)+2 OH��
CaSO4��2H2O(s)+2 OH��
�÷�Ӧ��ƽ�ⳣ������ʽK=_________________________��
��Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ������������ij���������ʣ�����pH="12.3" [��c(OH��)=0.02mol/L]����ʹ��Ӧ�ڳ����������С���Ӧ����ˣ�������Һ��ͨ��CO2����һ�������õ�Na2CO3��
��2����Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ�в�ֱ��ͨ��CO2����������_______________________________________________________________��
��3�����ӵ����������������������д�����㣩��_____________��______________��
��4����ƽ���ƶ�ԭ�����������������ʵ����ɣ�____________________________________����HA��ʾ�����ӵ����ʣ����ܷ�Ӧ�����ӷ���ʽ��дΪ_______________________��
��5��Na2CO3��Һ�д���ˮ��ƽ�⣺CO32����H2O HCO3����OH��������˵���������_________��
HCO3����OH��������˵���������_________��
a����ˮϡ�ͣ���Һ���������ӵ�Ũ�ȶ���С
b��ͨ��CO2����ҺpH��С
c������NaOH���壬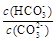 ��С
��С
d��ϡ����Һ��ƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������������Ӧ���ɰ�����ƽ�ⳣ�����±���
| | N2+3H2 2NH3 2NH3 | |||
| �¶� | 25�� | 200�� | 400�� | 600�� |
| ƽ�ⳣ��K | 5��108 | 650 | 0.507 | 0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪2A2(g) + B2(g) 2C(g)
2C(g)  H=" -a" kJ/mol(a��0)����һ���д����Ĺ̶��ݻ����ܱ������м���2molA2��1molB2����500���dz�ַ�Ӧ�ﵽƽ���C��Ũ��Ϊw mol/L���ų�����b kJ��
H=" -a" kJ/mol(a��0)����һ���д����Ĺ̶��ݻ����ܱ������м���2molA2��1molB2����500���dz�ַ�Ӧ�ﵽƽ���C��Ũ��Ϊw mol/L���ų�����b kJ��
��1��a b(�������=������)��
��2��������Ӧ�¶����ߵ�700�棬�÷�Ӧ��ƽ�ⳣ���� ���������С�����䡱����
��3������ԭ���������У�ֻ����2mol C��500��ʱ��ַ�Ӧ�ﵽƽ�����������c kJ��C��Ũ�� w mol/L(�������=������)��a,b,c֮��������ֹ�ϵ�� (�õ�ʽ��ʾ)��
��4����˵���÷�Ӧ�Ѿ��ﵽƽ���״̬���� ��
a����(C)=2��(B2) b��������ѹǿ���ֲ���
c����(��)(A2)=��(��)(B2) d�������ڵ��ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�о�С���һԪ�л�����HA���ܼ�����ˮ�Ļ����ϵ�е��ܽ�̶Ƚ����о�����25��ʱ������HA��ˮ�в��ֵ��룬��HAŨ��Ϊ ʱ��������Ϊ0.20������ȣ��ѵ����HA������/��ʼHA���ܷ����������ڱ��в��ַ���˫�ۣ����ɣ�HA��2����ƽ����ϵ�У�һԪ�л�����HA���ܼ�����B����ˮ��W���еķ���ϵ��ΪK��K��C��HA��B��C��HA��W��1.0�����ﵽƽ����Է�����ʽ���ڵ�HA�ڱ���ˮ�����ܼ��еı���Ϊ1��1��������Ϣ���£�
ʱ��������Ϊ0.20������ȣ��ѵ����HA������/��ʼHA���ܷ����������ڱ��в��ַ���˫�ۣ����ɣ�HA��2����ƽ����ϵ�У�һԪ�л�����HA���ܼ�����B����ˮ��W���еķ���ϵ��ΪK��K��C��HA��B��C��HA��W��1.0�����ﵽƽ����Է�����ʽ���ڵ�HA�ڱ���ˮ�����ܼ��еı���Ϊ1��1��������Ϣ���£�
| 25��ƽ����ϵ | ƽ�ⳣ�� | �ʱ� | ��ʼ��Ũ�� |
��ˮ�У�HA 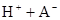 | 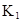 | 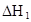 |  |
�ڱ��У�2HA 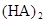 | 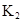 | 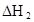 | 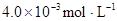 |
 ��HA��2����Ӧ�ڽϵ��¶����Է����У���
��HA��2����Ӧ�ڽϵ��¶����Է����У���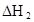 ___________0��
___________0��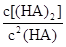 ��130����Ӧ��___________������С�
��130����Ӧ��___________������С��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��4�֣���һ���Ϊ10L�ܱյ������У�ͨ��һ������CO��H2O��g������850��ʱ�������·�Ӧ��CO(g)+H2O(g)  CO2(g)+H2(g) ��H��0
CO2(g)+H2(g) ��H��0
��1��CO��H2OŨ�ȱ仯��ͼ����0��4 min��ƽ����Ӧ���ʦ�(CO)��_______ mol/��L��min������ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ �� 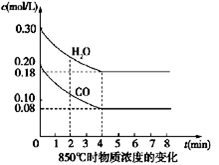
��2����������Щ���������ٷ����仯ʱ������������Ӧ�Ѵﵽƽ��״̬���� ��
| A����������ѹǿ |
| B�����������ܶ� |
| C��CO�����ʵ���Ũ�� |
| D���ܱ������зų����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������һ����Ҫ�Ļ�����Ʒ����������Ρ����صȵ�ԭ�ϡ���ҵ�ϳɰ��ķ�Ӧ����:N2(g) +3H2(g)  2NH3(g) ��H=һ92. 4 KJ��mol-1
2NH3(g) ��H=һ92. 4 KJ��mol-1
��1��2NH3(g)  N2(g) +3H2(g)�ں����ܱ������дﵽƽ��ı�־��
N2(g) +3H2(g)�ں����ܱ������дﵽƽ��ı�־��
�ٵ�λʱ��������3n mol H2:ͬʱ����2n mol NH3����NH3��N2��H2��ʾ��Ӧ���ʱ�Ϊ2��1��3 �ۻ��������ܶȲ��ٸı� �ܻ������ѹǿ���ٸı� �ݻ������ƽ����Է����������ٸı�
| A���٢ۢ� | B���٢ڢܢ� | C���٢ܢ� | D���ڢۢ� |
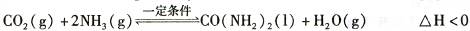
| ʱ�䣯min | ��0 | 30 | 70 | 80 | 100 |
| n(CO2) ��mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��CO2Ϊ̼Դ��ȡ��̼�л����Ϊ�����о����㣬����ΪCO2������ȡ�Ҵ��ķ�Ӧ�� 2CO2(g)+6H2(g)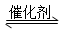 CH3CH2OH(g)+3H2O(g) ��Q��Q��0��
CH3CH2OH(g)+3H2O(g) ��Q��Q��0��
���ܱ������У���H2��CO2�����ʵ���֮��Ϊ3:1����Ͷ�ϣ���5MPa�²�ò�ͬ�¶���ƽ����ϵ�и������ʵ����������y%������ͼ��ʾ��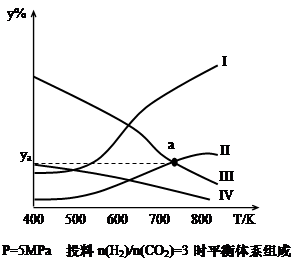
���������գ�
��1����ʾCH3CH2OH����������ߵ���_______��ѡ����ţ�
��2����һ���¶��·�Ӧ�ﵽƽ��ı�־��_______��ѡ����)
a��ƽ�ⳣ��K��������
b��CO2��ת���ʲ�������
c����������ƽ����Է����������ٸı䡡
d����Ӧ�ﲻ��ת��Ϊ������
��3�����������㶨����������CO2�ķ�Ӧ���ʣ����Բ�ȡ�ķ�Ӧ������_______��ѡ���ţ����ﵽƽ��������H2ת���ʵIJ�����_______��ѡ���ţ�
a�������¶� b����������H2
c����ȥ�Ҵ� d�������������
��4��ͼ������II��III�Ľ���a��Ӧ���������ya=_______%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com