


科目:高中化学 来源:不详 题型:单选题
| A.②③④ | B.①②③ | C.③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.溶液中Ca2+数减少 | B.[Ca2+]增大 |
| C.溶液pH不变 | D.溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 | ||||||||
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 | ||||||||
C.BaSO4和BaCO3共存的悬浊液中
| ||||||||
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.负极的电极反应式为:CO+O2-―2e=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是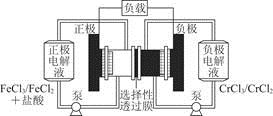
| A.充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1 |
查看答案和解析>>
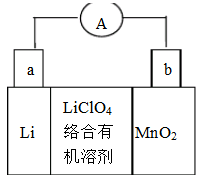
科目:高中化学 来源:不详 题型:单选题
| A.充电时阳极反应为Li++e-=Li |
| B.充电时动力电池上标注“-”的电极应与外接电源的负极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
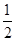 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
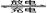 2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是
2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是| A.充放电时,溶液中Pb2+浓度保持不变 |
| B.充放电时,溶液的导电能力变化不大 |
| C.充电时,阳极反应式为:Pb2++2H2O-2e-=PbO2+4H+ |
| D.充电时,铅酸蓄电池的负极与外接电源的正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com