
����ͼ��ʾװ�ý�������ʵ��:
(1)�ڼ��װ�õ������Ժ�,���Թ�a�м���10 mL 6 mol��L-1��ϡ�����1 gͭƬ,�����ô��е��ܵ���Ƥ�������Թܿڡ���д�����Թ�a���п��ܷ��������з�Ӧ�Ļ�ѧ����ʽ����
(2)��ʵ������г�����Ӧ��ʼʱ���ʻ���,����ӿ�,����������������������������,����Ӧ����һ��ʱ�������������,ԭ��������
(3)���Ͽ���Ƶ�NO,�ɲ�ȡ�Ĵ�ʩ��������(��д��ĸ���)��
| A������ | B��ʹ��ͭ�� | C��ϡ��HNO3 | D�����������Ũ�� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£����ܼ�Ϊ1L���ܱ������ڷ���2molN2O4��8molNO2���������·�Ӧ2 NO2(����ɫ) N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������
N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������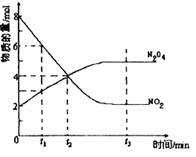
��1���ڸ��¶��£���Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ�� ��
��2����t1��10s��t2��20s�������t1��t2ʱ��N2O4��ʾ�ķ�Ӧ���ʣ� mol�� L-1�� s-1��
��3��ͼ��t1��t2��t3��һ��ʱ�̱�ʾ��Ӧ�Ѿ��ﵽƽ�⣿�� ��
��4��t1ʱ������Ӧ���� ����������������������淴Ӧ���ʡ�
��5��ά���������¶Ȳ��䣬����С�������������ƽ���� �ƶ��������Ӧ�������淴Ӧ�����䡱��
��6��ά��������������䣬�����¶ȣ��ﵽ��ƽ��ʱ��ϵ����ɫ ������������dz�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(6 ��)��������һ����Ҫ�����ȼ�ϣ�����ͨ��CH3OH���Ӽ���ˮ�Ƶã�2CH3OH(g) CH3OCH3(g)��H2O(g) ��H����23.5 kJ��mol��1����T1�棬�����ܱ������н�������ƽ�⣬��ϵ�и����Ũ����ʱ��仯��ͼ��ʾ��
CH3OCH3(g)��H2O(g) ��H����23.5 kJ��mol��1����T1�棬�����ܱ������н�������ƽ�⣬��ϵ�и����Ũ����ʱ��仯��ͼ��ʾ��
(1)�������·�Ӧƽ�ⳣ������ʽK��________����T1��ʱ����Ӧ��ƽ�ⳣ��Ϊ________��
(2)��ͬ�����£����ı���ʼŨ�ȣ�ijʱ�̸����Ũ������Ϊc(CH3OH)��0.4 mol��L��1��c(H2O)��0.6 mol��L��1��c(CH3OCH3)��1.2 mol��L��1����ʱ�����淴Ӧ���ʵĴ�С��v(��)________v(��)(�>������<������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Һ�У���ӦA��2B C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)
��0.100 mol/L��c(B)��0.200 mol/L��c(C)��0 mol/L����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ��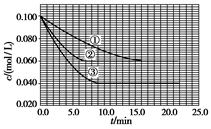
��ش��������⣺
(1)��ٱȽϣ��ں͢۷ֱ���ı�һ�ַ�Ӧ���������ı���������жϵ������ǣ�
�� ��
�� ��
(2)ʵ���ƽ��ʱB��ת����Ϊ ��ʵ���ƽ��ʱC��Ũ��Ϊ ��
(3)�÷�Ӧ�Ħ�H 0�����ж������� ��
(4)�÷�Ӧ���е�4.0 minʱ��ƽ����Ӧ���ʣ�
ʵ��ڣ�v(B)�� ��
ʵ��ۣ�v(C)�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�¶�ʱ��2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ�����
��1���÷�Ӧ�Ļ�ѧ����ʽΪ��
��2����Ӧ��ʼ��2min����X��ʾ��ƽ����Ӧ����Ϊ��
��3������������˵��������Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ��
A���������������ʵ�������ʱ��ı仯���仯
B����λʱ����ÿ����3mol X��ͬʱ����2mol Z
C��������������������ʱ��ı仯���仯
��4�����ܱ������ͨ��a mol X(g)��b mol Y(g)��������ӦX(g��+ Y(g��=2Z(g)�����ı���������ʱ����Ӧ���ʻᷢ��ʲô�仯��ѡ������� ��С�� ���䡱��
�� �����¶ȣ�
�ڱ���������������䣬����X(g)�����ʵ�����
�� ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸�����ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
CH3OH(g)��H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��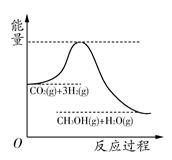
(1)������Ӧƽ�ⳣ��K�ı���ʽΪ________���¶Ƚ��ͣ�ƽ�ⳣ��K________(����������䡱��С��)��
(2)�����Ϊ2 L���ܱ������У�����1 mol CO2��3 mol H2�����CO2�����ʵ�����ʱ��仯���±���ʾ���ӷ�Ӧ��ʼ��5 minĩ��������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)��________��
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��10 mol A��5 mol B�����ݻ�Ϊ10 L���ܱ�������,ij�¶��·�����Ӧ:3A(g)+B(g) 2C(g),�����2 s��,����A��ƽ������Ϊ0.06 mol��L-1��s-1,����2 sʱ,�������� mol A,��ʱC�����ʵ���Ũ��Ϊ ��
2C(g),�����2 s��,����A��ƽ������Ϊ0.06 mol��L-1��s-1,����2 sʱ,�������� mol A,��ʱC�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(����Ԥ����)(1)��100 ����������½�0.100 mol��N2O4�������Ϊ1 L������ܱ������У�������Ӧ��N2O4(g) 2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
| ��t/s c/(mol��L��1)���� | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol��L��1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol��L��1) | 0 | 0.060 | b | c1 | c2 | c3 |
 H4SiO4(aq)����H
H4SiO4(aq)����H�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��ij���º��������µĿ��淴Ӧ��N2(g)+3H2(g)  2NH3(g) ��H��0����ʼ �����mol N2����mol H2�� �ﵽƽ���N2��H2��NH3�����ʵ����ֱ�Ϊ1 mol��3 mol��10 mol���ش��������⣺
2NH3(g) ��H��0����ʼ �����mol N2����mol H2�� �ﵽƽ���N2��H2��NH3�����ʵ����ֱ�Ϊ1 mol��3 mol��10 mol���ش��������⣺
��A= �� B= ��
�� ƽ����ٳ���5 molNH3����ѧƽ�⽫�� �ƶ�������ҡ����ƶ�����������ƽ��ʱN2�İٷֺ��� ԭƽ��ʱN2�İٷֺ���������ڡ���С�ڡ����ڡ�����
��ƽ����������¶ȣ���ƽ���� �����ƶ���������ѹǿ����ƽ����
�����ƶ�����������ҡ�����
��2��ij���º�ѹ�����µĿ��淴Ӧ��N2(g)+3H2(g)  2NH3(g)����ʼ����1 mol N2��3 mol H2��16 mol NH3���������ݻ�ΪV L���ﵽƽ���N2��H2��NH3�����ʵ����ֱ�ΪAmol��Bmol��c mol����ʱ�������ݻ�Ϊ1.1V L���ش��������⣺
2NH3(g)����ʼ����1 mol N2��3 mol H2��16 mol NH3���������ݻ�ΪV L���ﵽƽ���N2��H2��NH3�����ʵ����ֱ�ΪAmol��Bmol��c mol����ʱ�������ݻ�Ϊ1.1V L���ش��������⣺
�� ��ʼʱ��Ӧ����V�� V��������ڡ���С�ڡ����ڡ���
�� ƽ��ʱA= ��B= ��
�� ��ƽ����ٳ���3.6 molNH3�����½���ƽ��ʱ�������ݻ�Ϊ L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com