
| A. | NaOH溶液中通入过量的CO2:CO2+2OH-═CO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的浓HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | NaHCO3溶液中加入少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
分析 A.二氧化碳过量,反应生成碳酸氢钠;
B.氢碘酸过量,硝酸根离子在酸性条件下具有强氧化性,能够氧化碘离子;
C.氨水为弱碱,反应生成氢氧化铝沉淀;
D.氢氧化钡少量,离子方程式按照氢氧化钡的化学式组成书写.
解答 解:A.NaOH溶液中通入过量的CO2,反应生成碳酸氢钠,正确的离子方程式为:CO2+OH-═HCO3-,故A错误;
B.漏掉了硝酸根离子与碘离子的反应,正确的离子方程式为:10I-+3NO3-+Fe3++12H+═5I2+3NO↑+Fe2++6H2O,故B错误;
C.硫酸铝与氨水反应生成氢氧化铝沉淀和硫酸铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.碳酸氢钠溶液中加入少量Ba(OH)2溶液,反应生成碳酸钡沉淀、碳酸钠和水,反应的离子方程式为:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;B为易错点,注意硝酸根离子也参与反应.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |

| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 配制200mL4.6mol•L-1的稀硫酸需取该硫酸50.0mL | |
| D. | 常温下,5.6gFe与足量的稀硫酸反应转移电子的物质的量为0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
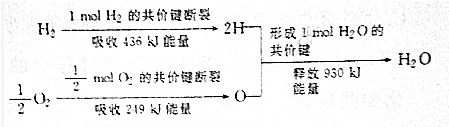
| A. | 氢气燃烧生成水蒸气时吸收热量 | |
| B. | 生成1molH2O吸收热量245kJ | |
| C. | 2molH和1molO所具有的能量大于1molH2和$\frac{1}{2}$molO2所具有的总能量 | |
| D. | 氢气和氧气的总能量大于水的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,向1L 0.10mol•L-1 CH3COOH溶液中通人HCl至溶液pH=7时溶液中氯离子与醋酸根离子的微粒数目之和为0.2NA | |
| B. | 25℃时,1L pH=12的NaOH溶液中,由水电离的H+数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | H2SO4(浓)+H2S=SO2↑+S↓+2H2O反应中,生成64gSO2时,转移的电子数目为6NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,SO2(g)和O2(g)所具有的能量大于SO3所具有的能量 | |
| B. | 将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com