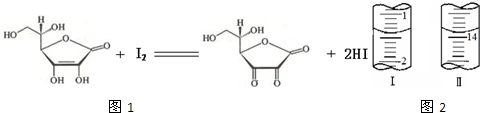
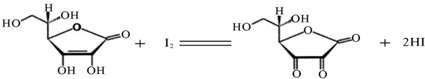解:(1)因为碘溶液的氧化性,在碱式滴定管中易腐蚀旋塞,所以用酸式滴定管存放;I
2遇淀粉变蓝,用淀粉指示滴入的碘是否过量,所以用淀粉溶液作指示剂;根据溶液的蓝色刚好出现,保持半分钟不变色来指示终点的到达;
故答案为:酸式;淀粉溶液;溶液的蓝色刚好出现,保持半分钟不变色.
(2)维生素具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定,所以待测维生素C溶液应在酸性介质中配制;
A.0.1mol?L
-1CH
3COOH溶液呈酸性,能将维生素C溶液在配制过程中加入到该试剂中,故A正确;
B.0.1mol?L
-1 HNO
3虽然呈酸性,但同时HNO
3具有强氧化性,能将维生素C氧化,故B错误;
C、0.1mol?L
-1NaOH呈碱性,维生素C在碱性溶液中易被空气氧化,故C错误;
D.0.1mol?L
-1Na
2SO
3水解呈碱性,维生素C在碱性溶液中易被空气氧化,故D错误;
故答案为:酸性;A;
(3)由于I
2易升华,无法准确称量碘的质量,所以不能用配制一定物质的量浓度的溶液方法精确配制标准I
2溶液,
故选A;
(4)消耗I
2溶液的体积为:13.90ml-1.40ml=12.50ml,
根据题中反应可知关系式:维生素C~I
2 0.00125mol 0.0125l×0.1mol?L
-1则100mL溶液中含维生素C:0.00125mol×4=0.005mol,质量为:0.005mol×176g/mol=0.88g,
样品中维生素C的质量分数为

×100%=88%,
故答案为:88%.
分析:(1)碘液的氧化性导致碱式滴定管下面的胶管被氧化;根据I
2遇淀粉变蓝,用淀粉指示滴入的碘是否过量;根据溶液的蓝色刚好出现,保持半分钟不变色来指示终点的到达;
(2)根据维生素C(C
6H
8O
6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定;
(3)根据碘的物理性质进行分析;
(4)根据维生素C与I
2的关系式求出维生素C的物质的量,然后再求出质量以及质量分数.
点评:本题主要考查了滴定操作以及误差分析、计算,需要注意的是淀粉可作标准I
2溶液滴定维生素C的指示剂,本题难度中等.

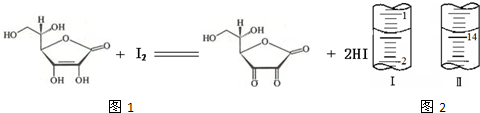
 ×100%=88%,
×100%=88%,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下: