【答案】
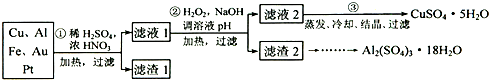
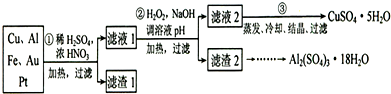
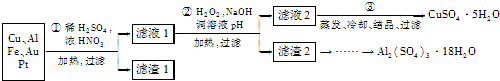
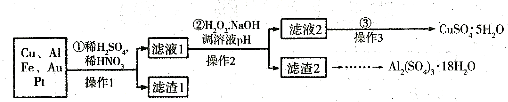
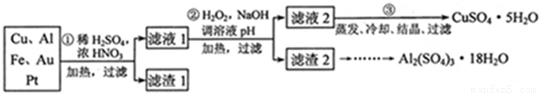
分析:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu
2+、Al
3+、Fe
2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu
2+、Al
3+、Fe
2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H
2O
2的作用是把Fe
2+氧化为Fe
3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe
3+和Al
3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)依据滴定实验和反应离子方程式计算得到;滴定实验误差分析依据标准溶液消耗的多少进行分析判断;
解答:解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu
2+、Al
3+、Fe
2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu
2+、Al
3+、Fe
2+;第①步Cu与酸反应的离子方程式为:Cu+4H
++2NO
3-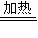
Cu
2++2NO
2↑+2H
2O 或3Cu+8H
++2NO
3-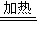
3Cu
2++2NO↑+4H
2O;Au、Pt;
故答案为:Cu+4H
++2NO
3-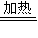
Cu
2++2NO
2↑+2H
2O 或3Cu+8H
++2NO
3-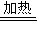
3Cu
2++2NO↑+4H
2O;Au、Pt;
(2)第②步加H
2O
2的作用是将Fe
2+氧化为Fe
3+;过氧化氢做氧化剂不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将Fe
2+氧化为Fe
3+;不引入杂质,对环境无污染;Fe
3+、Al
3+;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
故答案为:加热脱水;
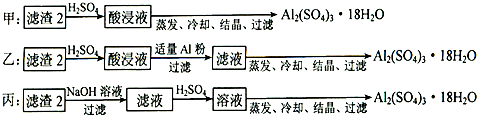
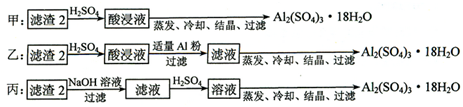
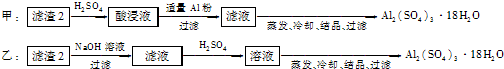
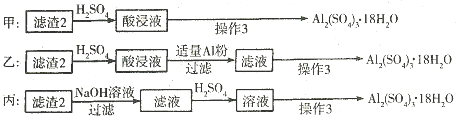
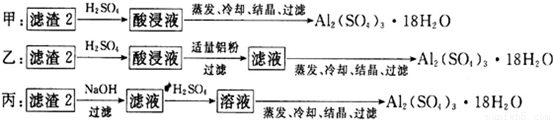
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H
2SO
4,生成Fe
2(SO
4)
3和Al
2(SO
4)
3,再加Al粉和Fe
2(SO
4)
3生成Al
2(SO
4)
3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)
3反应生成NaAlO
2,再在滤液中加H
2SO
4生成Al
2(SO
4)
3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al
2(SO
4)
3的原子组成没有关系,造成原子浪费;
故答案为:甲;所得产品中含有较多Fe
2(SO
4)
3杂质;乙;
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol?L
-1 EDTA(H
2Y
2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu
2++H
2Y
2-=CuY
2-+2H
+铜离子物质的量和标准液物质的量相同=cmol/L×b×10
-3L=bc×10
-3mol;依据元素守恒得到:
则20ml溶液中含有的CuSO
4?5H
2O物质的量为bc×10
-3mol;100ml溶液中含bc×10
-3mol×5=5bc×10
-3mol;
所以CuSO
4?5H
2O质量分数的表达式=
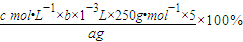
;
a.未干燥锥形瓶 对实验结果无影响;
b.滴定终点时滴定管尖嘴中产生气泡说明消耗标准液少,结果偏低;
c.未除净可与EDTA反应的干扰离子,消耗标准液多,结果偏高;
故答案为:
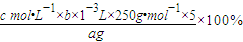
;c;
点评:本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目难度中等.

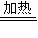 Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-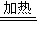 3Cu2++2NO↑+4H2O;Au、Pt;
3Cu2++2NO↑+4H2O;Au、Pt;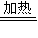 Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-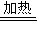 3Cu2++2NO↑+4H2O;Au、Pt;
3Cu2++2NO↑+4H2O;Au、Pt;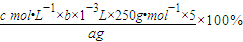 ;
;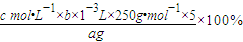 ;c;
;c;