
����Ŀ����������ȡ���������ͼ����֪���з�����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2KI===2KCl+I2����ش��������⣺

(1)ָ����ȡ��Ĺ������й�ʵ����������������ƣ�__________��________��
(2)��3 mL��ˮ�У�����1 mL���Ȼ�̼�������ú۲쵽�Թ���ķֲ���������ͼ�е�________(ע���Թ�����ɫ��Ϊ�Ϻ�ɫ��Һ)��

(3)�Ӻ�����л���Һ����ȡ��ͻ����л��ܼ������辭������ָ������ͼʵ��װ���еĴ���֮����(����װ�����ձ��ײ��ѵ���ʯ����)

��____________________________��
��____________________________��
���𰸡�
(1)���� ��ȡ����Һ
(2)D
(3)���¶ȼ��¶˵�ˮ�����ܲ�����Һ�У�Ӧλ��֧�ܿ�
��������(��������)��ˮ��������
��������
(1)������ҵ�����Һ����ɲ�������Һ��ͨ�����˵�ʵ�������ʵ�ֵģ������ˮ��Һת���ɺ�����л���Һ����Ҫ����ȡ�ٷ�Һ����ɡ�
(2)���Ȼ�̼���ܶȴ���ˮ���ֲ��λ���²㣬��ϵ�ˮ��CCl4������ֱ�Ϊ3 mL��1 mL�����ж�D��ȷ��
(3)������Ļ���ʵ��װ��ͼ��ԭ����֪���¶ȼ��¶˵�ˮ����Ӧλ��������ƿ��֧�ܿڴ�����������ˮ������ӦΪ�½��ϳ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2����֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2��
(1)�÷�Ӧ�еĻ�ԭ���� ��
(2)�÷�Ӧ�У�������ԭ��Ӧ�Ĺ����� �� ��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ŷ��������ת�Ƶķ������Ŀ�� ��
(4)����Ӧת����0.3 mol���ӣ�������������ڱ�״�������Ϊ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵ�������һ�������������Ĺ�沥�úܻ���������ʳ��ʱ����һ��ɫҺ����뵽һ��ɫ�����У�����װ���ĺ��ӣ��������������������ڣ�����ʳ���ˣ��dz����㡣�����Ʋ����ɫ�������ɫҺ������������ĸ���� �� ��
A. ����狀�ˮ B. Ũ�����ˮ
C. �����ƺ�ˮ D. �Ȼ��ƺ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ����Һ�п��ܴ�������Ag+��Mg2+��Fe3+�е�һ�ֻ������ӣ���ش�����������
(1)�����κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ������� ��
(2)ȡ����ԭ��Һ�������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��ɫ��������ʧ��˵��ԭ��Һ�п϶����ڵ������� �����ɵij����Ļ�ѧʽΪ ��
(3)ȡ(2)���ϲ���Һ�������NaOH��Һ�����ְ�ɫ������˵��ԭ��Һ�п϶����ڵ������� ��
(4)ԭ��Һ�п��ܴ������ڵ��������� (�����)��
A��Cl B��![]() C��
C��![]() D��OH
D��OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������⾷ҩ����Ч�ɷ����������أ���ṹ��ʽ��ͼ��ʾ�����й����������ص�˵���У���ȷ����

A. �������صķ���ʽΪC12H12O5
B. 1mol������������ܺ�2molNaOH��Ӧ
C. 1mol������������ܺ�4molH2�����ӳɷ�Ӧ
D. ����������һ�������¿��������ᷢ��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��

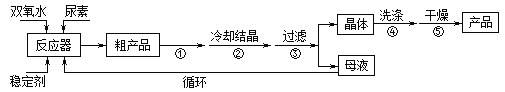
��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ���ݻ�Ϊ2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ������й�˵����������

A. �÷�Ӧ�Ļ�ѧ����ʽΪ3X+Y ![]() 2Z
2Z
B. 2 minʱ����Ӧ������ȣ�����ѧ��Ӧ���ڽ���
C. ��Ӧ��ʼ��2 min��Z�ķ�Ӧ����Ϊ0.05 molL��1min��1
D. ��Ӧ�ﵽƽ��ʱ��ѹǿ�ǿ�ʼʱ��0.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п����Ҫ�ɷ�ΪZnS��������FeS��CuS��CdS���ʡ����̿����Ҫ�ɷ�Ϊ MnO2��������A12O3��SiO2��������п������Ϳ�Ϊԭ���Ʊ�Zn��MnO2������������£��м����Ĺ��岿���Ѿ���ȥ����

��֪��I.��ʯ�����н���Ԫ������Һ�о���������ʽ���ڡ�
��.���ֽ���������ȫ������pH���±���
Zn2+ | Mn2+ | Fe2+ | Fe,3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
�ش��������⣺
��1��������з��������Ӧ������MnO2��FeS�����Ṳ��ʱ�е���ɫ������������Һ��Ϊ�ػ�ɫ��д��MnO2��FeS�����Ṳ�ȷ�����Ӧ�Ļ�ѧ����ʽ________________________________��
��2������ڼ������п��Ϊ�˻��ս��������ս�������Ҫ�ɷ���_______________��
��3���������MnO2����������ԭ��Ӧ�����ӷ���ʽ_________________������X������__________(����ĸ��ʾ��
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
��4�������п���ѭ�����õ�������____________���ѧʽ����
��5��MnO2��Li����LiMnO2���õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4�����ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2���ش��������⣺

�����·�еĵ����ƶ���������______������______��������ĸ����
��д��������ӵ�ص������缫��Ӧʽ_____________________________��
��6����֪��25��ʱ��HCN�ĵ��볣��K=4.9��10-10�� H2S�ĵ��볣��K1=1.3��10-7 ��K2=7.0 ��10 -15����NaCN��Һ��ͨ��������H2S���壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ��û���ͭ���������£�

����˵������ȷ����
A. ͭ�����ղ�����β�����ð�ˮ�����Ƴɻ�����Ʒ
B. ��ⷨ������ͭ�Ĺ����У�������ͭ��Һ���������Һ
C. ��Cu2O�� CO��Ӧʱ��CO����ԭ��CO2
D. ��ͭ����ʱ�����ؽ��������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com