
【题目】氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3,两步反应的能量变化示意图如下:

下列说法合理的是( )
A.该反应的催化剂是NO2
B.升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3
C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态
D.1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是
A. 既作氧化剂又作还原剂
B. 既不作氧化剂又不作还原剂
C. 作还原剂
D. 作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017长宁区一模】不能用勒夏特列原理解释的是( )
A.使用铁触媒,加快合成氨反应速率
B.过量空气有利于SO2转化为SO3
C.打开汽水瓶盖,即有大量气泡逸出
D.配置FeCl3溶液时,加入少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废水中常含有剧毒的NaCN,可用两段氧化法处理:
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:2NaOCN+3NaClO→Na2CO3+CO2↑+3NaCl+N2↑
完成下列填空:
(1)上述反应涉及的元素中,氮原子核外价电子数是______个;
O2—、Na+、Cl—中半径最小的是_____________。
(2)NaCN晶体中含有的化学键类型为_____________________________。
(3)第二段过程中,产物属于双原子分子的结构式是___________,该物质一般要比其他共价化合物如:NH3、H2S等都要稳定,其原因为:___________________;写出该物质的一种用途:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用物质的量浓度为0.100 0 mol·L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂。请填写下列空白:
(1) 用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液_________________,立即停止滴定。
(2) 下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 (填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出

(3) 若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为 mL。若仰视,会使读数偏___________(填“大”或“小”)。
(4) 再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是 mol·L-1。
滴定 次数 | 待测溶液 体积/mL | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | 1.34 | 19.39 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-10,下列叙述正确的是
=1×10-10,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合,所得混合溶液中水的电离得到促进
D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6mol·L-1的溶液
C.能够与Na反应生成H2的溶液
D.电解食盐水最后所得溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是

A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
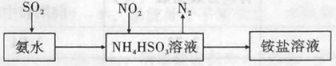
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
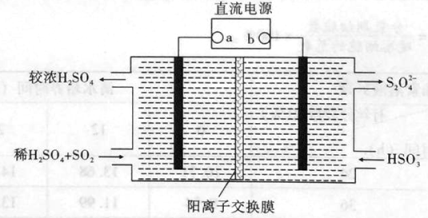
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com