
| ���� |
| �� |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |

| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ||
| ||
 ��
�� ��
��| H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
����һ����Ҫ�Ļ���ԭ�ϣ����ĺϳ���Ӧ���ǵ�����Ҫ�о�����֮һ����ͬ�¶ȡ�ѹǿ�£��ϳɰ�ƽ����ϵ��NH3�����ʵ����������±���N2��H2��ʼ���ʵ���֮��Ϊ1��3����
|
�⺬��(%) �¶�(��) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
�ش������й����⣺
��1�����ñ��������ƶϵó��ϳɰ��ķ�Ӧ��__________��Ӧ������ȡ��������ȡ����������仯������
��2�����ݱ������ݣ���200���100MPaʱ��ƽ����ϵ��NH3�����ʵ���������ߣ���ʵ�ʹ�ҵ������ѡ�ø���������Ҫԭ����___________________________________��
��3��һ�������£������ܱ������н��еĺϳɰ���Ӧ��ƽ���������������ʱ����ͬʱѹ������������������¶ȴ���ƽ�����ԭƽ����ȣ��뽫�й��������ı仯����������±��У����������С����������Ҳ���ܼ�С������
| ��Ӧ���� | ƽ�ⳣ��K | ����������� | |
| �仯��� |
��4����1molH2��1molN2ͨ��һ���������ܱ������У���һ���¶Ⱥʹ��������£���Ӧ�ﵽƽ�⣬���NH3�����ʵ���Ϊ0.3mol����ʱ������0.5molH2��0.5molN2����Ӧ�ﵽ�µ�ƽ��ʱ��NH3�����ʵ���Ϊ_____________��ѡ��𰸱�ţ���
A��0.3mol B��0.15mol C����0.15mol D������0.15mol����0.3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
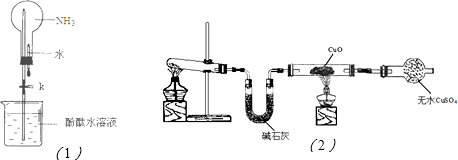
��16�֣�����һ����Ҫ�Ļ���ԭ�ϣ�ijѧϰС������ȡ������̽�������ʡ���ش�
��1��ʵ������ȡ�����Ļ�ѧ����ʽ�� ��
��2������ͼ�ǽ��а�����Ȫʵ���װ�ã�������Ȫ�IJ��������� ��
�ڰ���ʹ�ձ�����Һ����ɫ��Ϊ��ɫ����ԭ����_______________________________���õ��뷽��ʽ��ʾ����
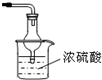
��3����С��ͬѧ�������ͼ��ʾ��ʵ��װ�ã����ּг�����δ��������̽�������Ļ�ԭ�Բ�������
�� ʵ������Ϊ����ɫCuO��Ϊ��ɫ����ɫ��ˮCuSO4��ĩ��Ϊ��ɫ��ͬʱ����һ����ɫ���壬����������Ⱦ����д��������CuO��Ӧ�Ļ�ѧ����ʽ ��
�� ��ʯ�ҵ������� ��
�۸�װ�ô�������ȱ�ݣ���ָ�����ڵ����Ⲣ����Ľ����
��
��4����ͬѧ��Ϊ��NH3��CuO��Ӧ���ɵĺ�ɫ�����п��ܺ���Cu2O����֪��Cu2O��һ�ּ����������������Һ�У�Cu+���ȶ��Ա�Cu2+�Cu+Cu + Cu2+����
�������һ����ʵ�����ú�ɫ�������Ƿ���Cu2O��
��
��5����ҵ�����еĵ�����������Ҫ�Ĵ�����Ⱦ��֮һ��Ϊ��������Ⱦ����ҵ�ϳ��ð�����֮������Ӧ��NOx+NH3��N2+H2O��ʹ��ת��Ϊ����N2 ������NO2��NO�Ļ������3.0 L����3.4 L��ͬ��ͬѹ�£�NH3��Ӧ��ǡ��ʹ��ȫ��ת��Ϊ��������ԭ��������У�NO2��NO���������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ��У������һ��������12�£����ۻ�ѧ�Ծ��������棩 ���ͣ������
����һ����Ҫ�Ļ�����Ʒ���ǵ��ʹ�ҵ���л��ϳɹ�ҵ�Լ��������ᡢ��� �ʹ����ԭ�ϣ�Ҳ��һ�ֳ��õ��������
(1) ʵ�����Ʊ������Ļ�ѧ��Ӧ����ʽΪ_________��
(2) ��ҵ�ϳɰ��ķ�Ӧ����ʽΪ��N2(g)��3H2(g) 2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
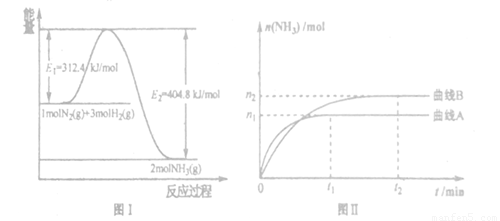
����˵����ȷ����_______��
A.��H����92.4kJ/mol
B.ʹ�ô�����ʹE1����ֵ����
C.Ϊ�����ת���ʣ���ҵ�����з�Ӧ��Ũ��Խ��Խ��
D.ͼII�Dz�ͬѹǿ�·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵͼ����PA<PB
E.ͼII�Dz�ͬ�¶��·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵͼ����TA>TB��
F.�÷�Ӧ��ƽ㕳���KA<KB
G.������A�����£���Ӧ�ӿ�ʼ��ƽ�⣬����N2��ƽ������Ϊ mol/(L��min)
mol/(L��min)
(3) �����¶��£���һ���ݻ�Ϊ2 L���ܱ�������ͨ��2 mol N2��7 mol H2���ﵽƽ��ʱ ���������ѹǿΪ��ʼʱ�� ��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______
��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______
(4)��֪H2(g)��ȼ����Ϊ285.8 kJ/mol����д����ʾNH3(g)ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽ _____������Ϊȼ�Ͽ�������ư�ȼ�ϵ�أ��缫���Ͼ�Ϊ���Ե缫,KOH��Һ���������Һ���õ�ظ����缫��ӦʽΪ_______���y�����õ���������ÿ�ų�1 mol N2ʵ���ṩ460 kJ�ĵ��ܣ����ȼ�ϵ�ص�ʵ��Ч��Ϊ_____(ȼ�ϵ�ص�ʵ��Ч����ָ���ʵ���ṩ�ĵ���ռȼ�ϵ�ط�Ӧ�����ͷų���ȫ�������İٷ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��������˳����2010�����һģ�������ۺϣ���ѧ���� ���ͣ�ʵ����
��16�֣�����һ����Ҫ�Ļ���ԭ�ϣ�ijѧϰС������ȡ������̽�������ʡ���ش�
��1��ʵ������ȡ�����Ļ�ѧ����ʽ�� ��
��2������ͼ�ǽ��а�����Ȫʵ���װ�ã�������Ȫ�IJ��������� ��
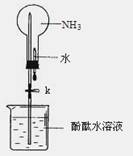
�ڰ���ʹ�ձ�����Һ����ɫ��Ϊ��ɫ����ԭ����_______________________________���õ��뷽��ʽ��ʾ����
��3����С��ͬѧ�������ͼ��ʾ��ʵ��װ�ã����ּг�����δ��������̽�������Ļ�ԭ�Բ�������

�� ʵ������Ϊ����ɫCuO��Ϊ��ɫ����ɫ��ˮCuSO4��ĩ��Ϊ��ɫ��ͬʱ����һ����ɫ���壬����������Ⱦ����д��������CuO��Ӧ�Ļ�ѧ����ʽ ��
�� ��ʯ�ҵ������� ��
�۸�װ�ô�������ȱ�ݣ���ָ�����ڵ����Ⲣ����Ľ����
��
��4����ͬѧ��Ϊ��NH3��CuO��Ӧ���ɵĺ�ɫ�����п��ܺ���Cu2O����֪��Cu2O��һ�ּ����������������Һ�У�Cu+���ȶ��Ա�Cu2+�Cu+ Cu + Cu2+����
Cu + Cu2+����
�������һ����ʵ�����ú�ɫ�������Ƿ���Cu2O��
��
��5����ҵ�����еĵ�����������Ҫ�Ĵ�����Ⱦ��֮һ��Ϊ��������Ⱦ����ҵ�ϳ��ð�����֮������Ӧ��NOx+NH3��N2+H2O��ʹ��ת��Ϊ����N2 ������NO2��NO�Ļ������3.0 L����3.4 L��ͬ��ͬѹ�£�NH3��Ӧ��ǡ��ʹ��ȫ��ת��Ϊ��������ԭ��������У�NO2��NO���������__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com