

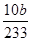 (2分)
(2分)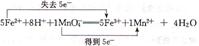 或
或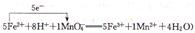
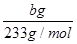 ×
×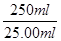 =
=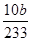 mol。(5)关于氧化还原反应离子方程式的配平,先根据得失电子守恒配平变价微粒,即n(MnO4-):n(Fe2+)=1:5,最后根据电荷守恒和质量守恒配平其他微粒的计量数。①双线桥的箭头是氧化剂指向还原产物,还原剂指向氧化产物,单线桥是还原剂指向氧化剂。
mol。(5)关于氧化还原反应离子方程式的配平,先根据得失电子守恒配平变价微粒,即n(MnO4-):n(Fe2+)=1:5,最后根据电荷守恒和质量守恒配平其他微粒的计量数。①双线桥的箭头是氧化剂指向还原产物,还原剂指向氧化产物,单线桥是还原剂指向氧化剂。

 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:不详 题型:单选题
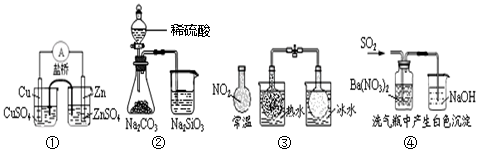
| A.①能组成Zn、Cu原电池 |
| B.②能证明非金属性:S>C>Si |
C.③说明反应2NO2 N2O4△H>0 N2O4△H>0 |
| D.④ 白色沉淀为BaSO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 |
| B.用托盘天平称取25.20 g NaCl |
| C.用100 mL的量筒量取5.2 mL的盐酸 |
| D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对滴定管仰视读数:23.80mL |
| B.将胆矾置于托盘天平右盘称量所得质量10.4g(左盘砝码10g,游码0.4g) |
| C.中和热测定时用铜棒代替环形玻璃搅拌棒搅拌,测定反应的最高温度:30.4℃ |
| D.用量简量取硝酸时,俯视读数:5.8mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳。 |
| B.利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果; |
| C.洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次; |
| D.用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
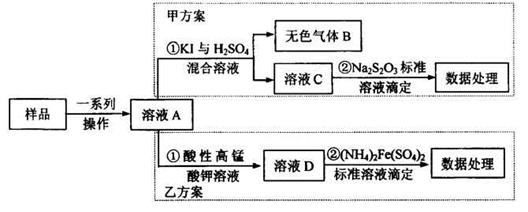
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
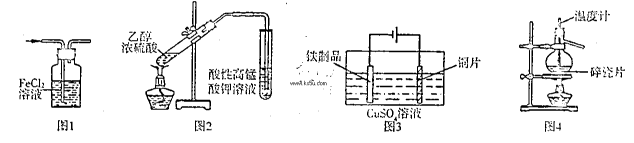
| A.用图1所示装置除去HCI气体中的少量C12 |
| B.用图2所示装置检验加热时产生的乙烯 |
| C.用图3所示装置在铁制品表面镀铜 |
| D.用图4所示装置分离溴的四氯化碳溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com