
����Ŀ��A��B��D���ɳ����Ķ����ڷǽ���Ԫ���γɵĵ��ʣ�������A�ǵ���ɫ��ĩ��B��D�����壬F��G��H����ɫ��Ӧ��Ϊ��ɫ��ˮ��Һ���Լ��ԣ�E��Ư���ԡ�����֮���ת����ϵ��ͼ��ʾ�����ֲ��P��Ӧ��������ȥ�����ش��������⣺
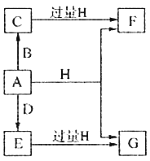
��1��A����Ԫ�������ڱ��е�λ��Ϊ______________��C�ĵ���ʽΪ_______________��
��2��A��H�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ__________________��
��3����A���ڷ��ڵ�G��Һ�п����Ƶû�����I��I��������Һ�в��ȶ��������ɵ����ʵ�����A��E��I����������������A��E�����ӷ���ʽΪ____________________��I����ǿ��ԭ�����ڷ�֯����ֽ��ҵ����Ϊ���ȼ�����I��Һ��ͨ�������ɷ�����Ӧ���μӷ�Ӧ��I�����������ʵ�����Ϊ1:4���÷�Ӧ�����ӷ���ʽΪ__________________��
��4������0.4molF��0.1molG�Ļ����Һ�м���������ᣬ��ȫ��Ӧ���ռ���aL����C����״������ȡ��Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g����a=____________________��
���𰸡� �������� ����A�� ![]() 3S + 6NaOH
3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O 2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O 2H+ + S2O32- ![]() S��+ SO2��+H2O 4Cl2 +S2O32-+ 5H2O
S��+ SO2��+H2O 4Cl2 +S2O32-+ 5H2O![]() 8Cl- + 2SO42- + 10H+ 2.24
8Cl- + 2SO42- + 10H+ 2.24
��������������A�ǵ���ɫ��ĩ����Ϊ���ʣ���A����B��D�����壬A��D����E��E��Ư���ԣ�˵��EΪSO2��D��O2����B��H2��CΪH2S��F��G��H����ɫ��Ӧ��Ϊ��ɫ��F��G��H�о�������Ԫ�أ�ˮ��Һ���Լ��ԣ�SO2��H2S������H��Ӧ��HΪNaOH����FΪNa2S��GΪNa2SO3����1��A�����ʣ�λ�ڵ������ڢ�AԪ�أ�CΪH2S�����ڹ��ۻ���������ʽΪ![]() ����2���������ȵ�����������Һ�����绯��Ӧ���������ƺ��������ƣ�����Ӧ����ʽΪ��3S + 6NaOH
����2���������ȵ�����������Һ�����绯��Ӧ���������ƺ��������ƣ�����Ӧ����ʽΪ��3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O����3��S�ͷ���Na2SO3�õ�������Na2S2O3��Na2S2O3����������������S��SO2�������ӷ�Ӧ����ʽΪ��2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O����3��S�ͷ���Na2SO3�õ�������Na2S2O3��Na2S2O3����������������S��SO2�������ӷ�Ӧ����ʽΪ��2H+ + S2O32- ![]() S��+ SO2��+H2O����������ǿ�����ԣ��ܰ�S2O32��������SO42������������ԭ��Cl����Na2SO3�����������ʵ���֮��Ϊ1��4�������ߵ�ϵ��Ϊ1��4��S2O32����4Cl2��2SO42����8Cl�������ݻ�ѧ��Ӧ����ʽԭ�Ӹ����غ㣬��Ӧǰ��5��O����ȱ��5molH2O������������Ӧ��10H���������ӷ�Ӧ����ʽΪ4Cl2��S2O32����5H2O=8Cl����2SO42����10H������4����Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g�����ݷ�Ӧ2Fe3����S2��=2Fe2����S�����÷�Ӧ�����ĵ�Na2SΪ0.1mol��Na2S��Na2SO3�Ļ����Һ�м���������ᣬ������Ӧ��2S2����SO32����6H��=3S����3H2O������Na2SO3 0.1mol��ʣ���Na2S 0.1mol�����ᷴӦ�ų�H2S���ų�H2S�����ʵ���Ϊ0.1mol����״���µ����Ϊ2.24L��
S��+ SO2��+H2O����������ǿ�����ԣ��ܰ�S2O32��������SO42������������ԭ��Cl����Na2SO3�����������ʵ���֮��Ϊ1��4�������ߵ�ϵ��Ϊ1��4��S2O32����4Cl2��2SO42����8Cl�������ݻ�ѧ��Ӧ����ʽԭ�Ӹ����غ㣬��Ӧǰ��5��O����ȱ��5molH2O������������Ӧ��10H���������ӷ�Ӧ����ʽΪ4Cl2��S2O32����5H2O=8Cl����2SO42����10H������4����Ӧ�������Һ���������FeCl3��Һ���õ�����3.2g�����ݷ�Ӧ2Fe3����S2��=2Fe2����S�����÷�Ӧ�����ĵ�Na2SΪ0.1mol��Na2S��Na2SO3�Ļ����Һ�м���������ᣬ������Ӧ��2S2����SO32����6H��=3S����3H2O������Na2SO3 0.1mol��ʣ���Na2S 0.1mol�����ᷴӦ�ų�H2S���ų�H2S�����ʵ���Ϊ0.1mol����״���µ����Ϊ2.24L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����鰱�������ã�������
A.ʪ��ĺ�ɫʯ����ֽ
B.����ĺ�ɫʯ����ֽ
C.�������ɫʯ����ֽ
D.ʪ�����ɫʯ����ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£������������������ͬ������Ҫԭ����
A.����ķ��Ӵ�С��ͬB.������Ӽ��ƽ�����벻ͬ
C.��������ʵ�����ͬD.��������ʲ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ÿ����������ȵļӴ�����չ������ȼ�ϵ��������Ϊ�о����⡣��ͼ��ij��������Ƶ�Һ��ȼ�ϵ��ʾ��ͼ�������й���������ȷ����

A. �õ�ص��ŵ��Dz�������Ⱦ���壬��Һ��ȼ�ϱ���Я��
B. ����ڲ�ʹ�õ��������ӽ���Ĥ��OH-������Ĥ����
C. ��ȼ�ϵ�صĵ缫���ϲ��ö������̼���ϣ���ͼ����Ŀ��������Ӵ����������������
D. �õ����ͨ��N2H4�ĵ缫Ϊ�����������ĵ缫��ӦʽΪN2H4+4OH--4e-=N2��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�ÿ��Դﵽʵ��Ŀ�ĵ���(����)


A. ��װ�ÿ���ʵ��Cl2����ȡ���ռ���β������
B. ��װ�ÿ���ʵ��������������ȡ���ռ�
C. ��װ�ÿ����γ�Cu��Znԭ���
D. ��װ�ÿ�֤��H2CO3�����Դ���H2SiO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��������������Ӧ�ù㷺������ѧ֪ʶ�ش�����:
��1��������һ�ֿ�ȼ��Һ�壬���������ȼ�ϡ���֪32.0gN2H4��H2O2��Ӧ���ɵ�����ˮ(��̬)���ų�����642kJ���÷�Ӧ���Ȼ�ѧ����ʽ��:____________��
��2��ȡ300mL0.2mo/L��KI��Һ��һ������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ���I2��KIO3��������KMnO4�����ʵ�����__________mol��
��3���Լ״�(CH3OH) Ϊȼ�ϵĵ���У��������ҺΪ���ԣ����ĵ缫��ӦΪ��__________��
��4������������Ŀǰ�����Ϲ��ϵ�����һ���ĸ�Ч�����ס���ȫ��ɱ�������ʼ����ҹ���ѧ���з���������������������(NaClO2) �����Ʊ��������ȵķ������仯ѧ����ʽΪ___________��
��5����Fe(NO3)3��Һ�м���Na2SO3��Һ����Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ�����ӷ���ʽ��__________���ֱ�Ϊ�ػ�ɫ��ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E�����л�����й���Ϣ��
A | B | C | D | E |
����ʹ��ˮ��ɫ | ����C��H�� | ����C��H��O����Ԫ����� | ����Է������� | ����C��H��O����Ԫ����� |
���ݱ�����Ϣ�ش��������⣺
��1��A��ˮ��һ�������·�Ӧ���ɵ�����C���������ƣ���д����һ�������£�A���ɸ߷��ӻ�����Ļ�ѧ����ʽ�� ��
��2��A�����������ӳɷ�Ӧ�����ɷ���F����F�ڷ�����ɺͽṹ�����Ƶ��л�����һ���ࣨ�׳ơ�ͬϵ��������Ǿ�����ͨʽ �� ��n=ʱ�������л��↑ʼ����ͬ���칹�壮
��3��B���е�������������ţ��� ����ɫ��ζҺ�� ���ж� �۲�����ˮ ���ܶȱ�ˮ��
���κ������²���������Ӧ ��ʹ���Ը��������Һ����ˮ����ɫ
д����Ũ���������£�B��Ũ���ᷴӦ�Ļ�ѧ����ʽ�� ��
��4��д����C��������D�Ļ�ѧ����ʽ�� ��
��5��C��E��Ӧ��������Է�������Ϊ100�������÷�Ӧ����Ϊ���仯ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵͼ��������˵����ȷ����

A. Y��R����Ԫ�ص���̬�⻯���ȶ��ԣ�Y>R
B. �����ӵİ뾶��X<Z<M
C. ����������Ӧˮ��������ԣ�R<N
D. ��X��N����Ԫ����ɵĻ����ﲻ�����κ��ᷴӦ��������ǿ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ݰ�ɫ����ֱ�Ϊ̼���ơ�̼�����Ƽ����ߵĻ���ij��ѧ����С�����������ʵ���̽����
I.����ͬѧ���ü��ȵķ���ȷ����ɷ֡�
(1)��������ƽ��ҩ�ס����żܡ������ǡ��������������⣬��ɱ�ʵ�黹��Ҫ��ʵ��������_________��
(2)��С��ͬѧȷ��ȡһ��������Ʒm1g����μ��ȡ���ȴ������ֱ�����أ�����Ϊm2g�����ݵó����ۣ�������±���
m2��m1�Ĺ�ϵ | ���� | |
�� | ��ƷΪNa2CO3 | |
�� | ��ƷΪNaHCO3 | |
�� | ��ƷΪNa2CO3�� NaHCO3�Ļ���� |
II.����ͬѧ�����Ѽ������NaHCO3��Na2CO3����������ʵ�飬���ڡ��ܷ���CaCl2�����NaHCO3��Na2CO3�����������̽����
(3)С��ͬѧ�Ƚ�NaHCO3��Na2CO3��CaCl2����ֱ����Ƴ�0.5mol/L����Һ����֭����ʵ�鷽����
��1
ʵ�鷽�� | Ԥ������ | |
ʵ��1 | ��2mL Na2CO3��Һ�еμ�1mL CaCl2��Һ | �а�ɫ�������� |
ʵ��2 | ��2mL NaHCO3��Һ�еμ�1mL CaCl2��Һ | �ް�ɫ�������� |
����֪:��������,0.5mol/L NaHCO3��ҺpH=8.5����Һ��c(HCO3-)=0.49 mol/L ��
��������, H2CO3�Ķ������볣��K2=5.6��10-11��
��Ksp(CaCO3)=2.8��10-9��
�Թ���ʹ0.5mol/L NaHCO3��Һ�е�CO32-���������c(Ca2+)Ӧ������_____mol/L�����ɴ˵ó����ۣ�ʵ��2��Ԥ������_____(���ȷ������ȷ��)��
��ʵ��ʵ����̷���ʵ��2������Ϊ��ɫ����������ɫ�������ɡ��������Ӧ�����ӷ���ʽΪ_____________��
(5)��С��ͬѧ�������ʵ���NaHCO3��Һ��CaCl2��Һ�ķ�Ӧ����̽������������ѹ���������õ��IJ���ʵ���������£�(ע��CaCl2��ҺŨ����ͬ)
��2 ����������Ũ�ȴﵽ10000ppm����ʱ��
C(NaHCO3)/(mol/L) | ����ʱ��/s | |||
v(CaCl2)��v(NaHCO3) | ||||
1:5 | 2:5 | 4:5 | 1:1 | |
1.0 | 142 | 124 | 114 | 156 |
0.5 | 368 | 264 | 244 | 284 |
0.25 | 882 | 450 | 354 | 632 |
0.1 | 1126 | 1316 | 816 | 1816 |
��ʵ�����ݿɵó��Ľ����ǣ�
�ٵ�v(CaCl2)��v(NaHCO3)һ��ʱ������_____�������ݳ����ʼ�С��
��NaHCO3Ũ����0.1��1.0mol/L��v(CaCl2)��v(NaHCO3)�ı�ֵΪ____ʱ�������ݳ�������죬�ɻ�������ʵ��۲�Ч����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com