
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南师大附中高三第四次月考化学试卷 题型:选择题
下列反应的离子方程式正确的是( )
A.NaHSO3溶液中滴加过量的Ba(OH)2溶液:
2HSO1—2OH-Ba2+ BaSO3↓+SO32-+2H2O
BaSO3↓+SO32-+2H2O
B.新制的硫酸亚铁溶液和过氧化氢溶液反应:Fe2++2H++H2O2 Fe3++2H2O
Fe3++2H2O
C.FeCl3溶液中滴加过量的氨水: Fe3++3NH2·H2O Fe(OH)3↓+3NH4+
Fe(OH)3↓+3NH4+
D.向100mL 3mol·L-1FeBr3溶液中通入标准状况下3.36L Cl2:
2Fe2++4Br-+3Cl2 2Fe3++2Br2+6Cl-
2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl.3??6H2O晶体。(图中夹持及尾气处理装置均已略去)
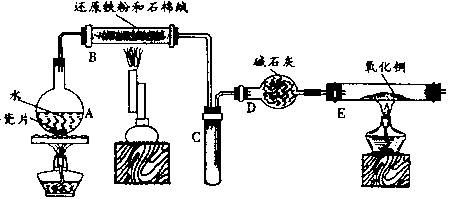
(1)装置B中发生反应的化学方程式是_________________________ ______;
(2)反应前向A中放入碎瓷片的目的是_______________________________,装置A、B、E、三处均需要加热,A、B、E三处加热的先后顺序是(用A、B、E表示) ;
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。向滤液中加入KSCN溶液,溶液不显红色,说明滤液中不含有![]() 离子,你认为滤液中不含有
离子,你认为滤液中不含有![]() 离子可能的原因是:__________________________________________。
离子可能的原因是:__________________________________________。
(4)该小组利用(3)中滤液制取FeCl3??6H2O晶体设计流程如下:
![]()
①步骤I若向100mL滤液中通入224mL Cl2(标准状况下)恰好完全反应,则原滤液中金属离子浓度约为__________mol/L。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_______________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合必要的离子方程式简要说明)
__________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com