
高二化学期中质量检测试题(卷)
注意事项: 2008.10
1.本试题分为第Ⅰ卷1至3页, 第Ⅱ卷4至6页。 满分100分。
2.答第Ⅰ卷前,考生务必将答题卡及第Ⅱ卷密封线内项目填写清楚。
3.考生答题时,必须将第Ⅰ卷上所有题的正确答案用2B铅笔涂在答题卡上所对应的信息点处,答案写在Ⅰ卷上无效。
可能用到的相对原子质量: H-1 C-12 O-16 Ca -40 Cl -35.5
第Ⅰ卷 (选择题,共50分)
一.选择题(仅一个选项符合题意, 1-10题2分,11-20题3分,共50分)
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
2.决定化学反应速率的主要因素是
A.各反应物质的性质 B.各反应物、生成物的浓度
C.加入催化剂 D.温度和压强
3.已知:(1)Zn(s)+1/2O2(g) = ZnO(s);△H =-348.3 kJ/mol
(2)2Ag(s)+1/2O2(g) = Ag2O(s); △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于
A.-317.3 kJ/mol B.-379.3 kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
4.有如下三个热化学方程式:H2(g)+O2(g)=H2O(g); △H=a kJ/mol
H2(g)+O2(g)=H2O(1) ; △H =b kJ/mol
2H2O(1)=2H2(g)+O2(g) ; △H =c kJ/mol
关于它们的下列表述,正确的是
A.它们都是吸热反应 B.a、b、c均为负值
C.反应热的关系a=b D.反应热的关系2b=-c
5.下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.原电池是将电能转化为化学能的一种装置
C.中和反应都是放热反应
D.水力发电是将化学能转化为电能的过程
6.在
A.υ(A)= 0.5 mol/(L?s) B.υ(B)= 0.3 mol/(L?s)
C.υ(C)= 0.8 mol/(L?s) D.υ(D)= 1 mol/(L?s)
7.在可逆反应中,改变下列条件一定能加快反应速率的是
A.增大反应物的量 B.升高温度 C.增大压强 D.使用催化剂
8.在一定条件下,下列可逆反应达到化学平衡:
I2 (g)
+H2 (g)  2 HI (g) (正反应是放热反应)
2 HI (g) (正反应是放热反应)
要使混合气体的颜色加深,可以采取的方法是:
A.升高温度 B.增大H2的浓度 C.降低温度 D.减小压强
9.氙和氟按一定比例混合,在一定条件下反应,达到以下平衡Xe(g)+ XeF4(g)(正反应吸热)既能加快反应速率,又能使平衡向正反应方向移动的条件是
XeF4(g)(正反应吸热)既能加快反应速率,又能使平衡向正反应方向移动的条件是
A. 加入催化剂 B. 适当降温 C. 减压 D. 加压
10.能用能量判据判断下列过程的方向的是
A.放热反应容易自发进行,吸热反应不能自发进行
B.有序排列的火柴散落时成为无序排列
C.水总是自发的由高处往低处流
D.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大
11.有一可逆反应:
(1)0.8mol A,1.2mol B,1.2mol C,2.4mol D
(2)1.4mol A,2.1mol B,0.6mol C,1.2mol D
达到平衡后,C的质量分数相同,则x的值为
A. 1 B.
12.完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
13.已知:CH4(g)+2O2(g) = CO2(g)+2H2O(1) △H =?Q1 KJ/mol
2H2(g)+O2(g) = 2H2O(g) △H = ?Q2 KJ/mol
2H2(g)+O2(g) = 2H2O(1) △H = ?Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
14.当“嫦娥一号”发射升空时,在三级动力中采用了氢氧燃料。已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ?mol-1
B. 2H2(g)+O2(g)=2H2O (l) ΔH=-484kJ?mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ?mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ?mol-1
15.在
16.一定条件下反应2AB(g)
 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
17.在一定温度下将1 mol CO和1 mol H2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g)
 CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6 mol,再通入4 mol H2O(g)达到平衡后CO2的物质的量可能是
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6 mol,再通入4 mol H2O(g)达到平衡后CO2的物质的量可能是
A.等于0.6 mol B.等于1 mol
C.大于1 mol D.大于0.6 mol,小于1 mol
 18.在相同温度和压强下,对反应CO2(g)+H2(g)
18.在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见右表,表中四种情况达到平衡后,n(CO)的大小顺序是
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见右表,表中四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲
B.乙>丁>甲>丙
C.丁>乙>丙=甲
D.丁>丙>乙>甲
19.在容积一定的密闭容器中,反应 B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
A.其他条件不变,加入少量C,物质A的转化率增大
 B.正反应是放热反应,且A是气态
B.正反应是放热反应,且A是气态
C.正反应是吸热反应,且A不是气态
D.改变压强对该平衡的移动无影响
20.一定条件下,在某容器中充人N2和H2,反应N2+3H2 2NH3(正反应为放热反应)达到平衡。当某一条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡,下列条件改变符合右上图中变化的是
2NH3(正反应为放热反应)达到平衡。当某一条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡,下列条件改变符合右上图中变化的是
A.充入氮气同时分离出氨 B.升高温度
C.增大压强 D.减小压强
高二化学期中质量检测试题(卷)
2008.10
第Ⅱ卷(非选择题 共50分)
题号
二
三
四
总 分
总分人
21
22
23
24
25
26
得分
复核人
得分
评卷人
二.填空题(21题9分,22题9分, 共18分)
21.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
22.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为 ℃。
得分
评卷人
三.实验题和推断题(23题12分,25题9分 共 21分)
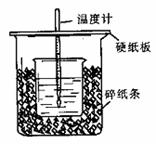 23.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
23.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热
数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),
(5)用相同浓度和体积的氨水(NH3?H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
24.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,
相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
反应进程(分钟)
1
2
5
15
20
3.0mol/L盐酸
少量气泡
较多气泡
大量气泡
反应剧烈
铝片耗尽
1.5mol/L硫酸
均无明显现象(无气泡产生)
3.0mol/L硫酸
均无明显现象(无气泡产生)
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式 ,
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:
假设二:
得分
评卷人
四.计算题(25题6分,26题6分 共12分)
25.对于下列反应:2SO2 + O2  2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为
。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为
。
26. t℃时,将3molA和2molB气体通人体积为 xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x= 。
(2)比较达到平衡时,A、B两反应物的转化率:
α(A) α(B) (填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是 (填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(第四问选做6分)
(4)在t℃时,若向原平衡混合物的容器中再充人amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充
人B mol (用含a的式子表示),达新平衡时,A的物质的量为n(A) (用含a的式子表示)
2008.10
一、选择题(1---10题每空2分,11―20题每空3分;共50分)
1
2
3
4
5
6
7
8
9
10
B
A
A
D
C
B
B
A
D
C
11
12
13
14
15
16
17
18
19
20
B
D
A
A
B
D
D
A
C
C
二.填空题 (21题9分,22题9分。共18分)
21. (每空3分,共9分)
(1)N2H4(l)+2H2O2(l)=N2(g) +4H2O(g) △H=-644.25 KJ/mol
(2)410.125
(3)产物不会造成环境污染。
22. (每空2-3分 共9分)
(1) ;(3分)
;(3分)
(2)吸热; (2分)
(3)b、c; (2分)
(4)830 (2分)
三.实验题和推断题(23题12 分,24题 9分, 共21分)
23.(每问2分,共12分)
(1)环形玻璃搅拌棒 (2分)
(2)减少实验过程中的热量损失 (2分)
(3)偏小 (2分)
(4)不相等;相等; (4分)
(5)偏小 (2分)
24.(每空3分 共9分)
(1)2Al + 6H+ = 2Al3+ + 3H2↑ (3分)
(2)反应放出热量,温度升高,使化学反应速率加快(3分)
(3)(说明:可能存在多种假设,但只要假设合理均可)Cl-能够促进金属铝与H+反应;SO42- 对H+与金属铝的反应起阻碍作用。(3分)
【解析】氢离子浓度和铝片均相同,造成的差异应该与反应
(即2Al + 6H+ = 2Al3+ + 3H2↑)所处环境的不同(Cl- 和SO42-)有关。
四.计算题 (12分)
25.(每空2分,共6分)
2mol/(L?min);
1mol/(L?min);
2mol/L
26.(6分)
⑴x=4
⑵ >
⑶ C
(第四问选做)
(每空3分,共6分)
(4) a/4;
2.4+
(解析)
由已知得 消耗B=0.2mol 生成C 0.4mol/L*
所以x=4
由于此反应方程式前后系数和相等,则压强变化对平衡不起作用,所以只需把所有物质化到一边,使物质的量成比例即可。原平衡前为A:B=3:2,题中加入amolC,就是
原平衡时A,B,C的摩尔比为2.4:1.8:0.8,新平衡也满足这个比例
x/(a-4x/3)=3 所以x=
所以n(A)=(2.4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com