
2009届北京市海淀区高三年级第一学期期末练习化学
2009.1
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至3页,第Ⅱ卷4至8页,共100分。考试时间120分钟。答题时请将第Ⅰ卷每小题的正确答案选出后,填在第4页答卷表格的相应空格中,若仅答在第Ⅰ卷上则不给分。请将第Ⅱ卷各题的答案直接答在试卷的相应位置上。
可能用到的相对原子质量:
H
第Ⅰ卷(选择题 共45分)
本卷共15道小题,每小题3分,共45分。在每小题列出的四个选项中,选出符合题目要求的一个选项。
1.下列叙述不正确的是
A.二氧化硅是光导纤维的主要原料
B.某些药皂中含有苯酚,说明苯酚是无毒的
C.淀粉、纤维素、蛋白质属于天然高分子化合物
D.国家严禁在食品及动物饲料中添加的三聚氰胺是有机物
2.下列叙述不正确的是
A.易溶于水的物质一定是电解质
B.有化学键断裂的变化不一定是化学变化
C.熔化状态下能导电的物质不一定是离子晶体
D.水受热不易分解,与水分子之间存在氢键无关
3.取少量无机盐溶液试样对其中的离子进行检验。下列判断正确的是
A.加入盐酸,产生白色沉淀,则试样中一定有Ag+
B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-
C.加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42-
D.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有NH4+
4.一次性使用的聚苯乙烯( )材料易造成“白色污染”,其替代物聚乳酸(
)材料易造成“白色污染”,其替代物聚乳酸( )是由乳酸(
)是由乳酸( )聚合而成的,聚乳酸可在乳酸菌的作用下降解。下列说法中正确的是
)聚合而成的,聚乳酸可在乳酸菌的作用下降解。下列说法中正确的是
A.聚苯乙烯的单体为 B.聚苯乙烯与聚乳酸的聚合方式相似
B.聚苯乙烯与聚乳酸的聚合方式相似
C.聚苯乙烯和聚乳酸均为纯净物 D.乳酸可发生消去反应
5.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是
选项
被提纯的物质(杂质)
除杂试剂
分离方法
A
NH3(H2O)
浓硫酸
洗气
B
乙酸乙酯(乙酸)
饱和碳酸钠溶液
分液
C
KCl固体(I2)
KOH溶液
加热
D
苯(苯酚)
浓溴水
过滤
6.在下列条件下,一定能大量共存的离子组是
A.在透明的溶液中:Fe2+、H+、I-
B.在pH=1的溶液中:Cl-、NH4+、ClO-
C.滴加KSCN试剂呈红色的溶液中:K+、SO32―、HCO3―
D.在由水电离出的c(H+)×c(OH-)=1×10-24 的溶液中:CH3COO-、 F-、Na+
7.有机物M的结构简式为: ,有关M的下列叙述中正确的是
,有关M的下列叙述中正确的是
A.可与H2反应,1 mol M最多消耗1 mol H2
B.可与浓溴水反应,1 mol M最多消耗4 mol Br2
C.可与NaOH溶液反应,1 mol M最多消耗3 mol NaOH
D.常温下,M在水中的溶解度小于苯酚在水中的溶解度
8.下列离子方程式书写正确的是
A.碘化亚铁溶液通入少量氯气:2Fe2+ + 2I- +2Cl2 = 2Fe3+ + 4Cl- +I2
B.苯酚钠溶液通入少量二氧化碳:C6H5O-+CO2+H2O=C6H5OH+CO32-
C.碳酸氢钠溶液加入少量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.硫酸氢铵溶液加入足量氢氧化钡溶液:2NH4++Ba2++SO42-+2OH-=BaSO4↓+2NH3?H2O
 9.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是
9.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色
A.①④ B.②③ C.①⑤ D.②⑤
10.只用试管和胶头滴管就可以鉴别的下列各组溶液是
①AlCl3溶液和NaOH溶液 ②Ca(HCO3)2溶液和NaOH溶液
③NaAlO2溶液和盐酸 ④Al2(SO4)3溶液和氨水 ⑤AgNO3溶液和氨水
A.①③⑤ B.①②③ C.②③④ D.③④⑤
11.已知热化学方程式C2H2 (g) +  O2 (g)= 2CO2 (g) + H2O
(g);ΔH= -1256 kJ/mol,下列说法正确的是
O2 (g)= 2CO2 (g) + H2O
(g);ΔH= -1256 kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256 kJ /mol
B.若转移10 mol电子,则消耗2.5 mol O2
C.若生成2 mol 液态水,则ΔH = -2512 kJ/mol
D.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ
12.对于反应O3+ I-+ H+ ― I2 + O2+H2O(未配平),下列说法正确的是
A.O2和H2O是还原产物
B.该反应能说明O2氧化性大于I2
C.氧化产物与还原产物的物质的量之比是1∶1
D.配平后的化学方程式为:2O3 + 2I-+ 4H+ = I2 + 2O2 + 2H2O
13.下列说法不正确的是
A.金属元素的最外层电子数不一定小于4
B.ⅠA族元素形成的单质的熔点随原子序数的递增而降低
C.同主族第三、第四周期的元素原子序数之差不一定等于18
14.某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极收集到气体总体积为22.
A.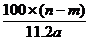 g B.
g B.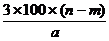 g
g
C.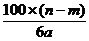 g D.
g D.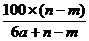 g
g
15.9.
A.0.3 mol/L B.0.4 mol/L C.0.5 mol/L D.0.6 mol/L
第Ⅱ卷(非选择题 共55分)
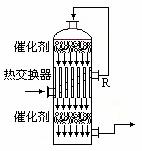 16.(共6分)
16.(共6分)
请根据工业制硫酸的有关知识回答下列问题
(1)黄铁矿在沸腾炉中反应的化学方程式为 。
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向, 则在R处流出的气体中除N2外的主要组成为(填序号) 。
a.SO2
b.SO2、SO
(3)接触法制硫酸过程中:2SO2(g) + O2(g)
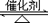 2SO3(g)
2SO3(g)
根据下表中的数据判断下列图像正确的 。

 SO2 转化率 压强
SO2 转化率 压强
温度
P1 ( MPa)
P2( MPa)
99.6
99.7
96.9
97.8
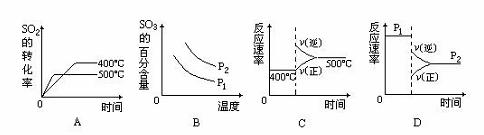
(4)下图是工业制硫酸的尾气的综合利用,气体M回收后可进入接触室循环生产,请根据图示判断X是(填名称) ,写出Y与硫酸反应生成M的化学方程式 。

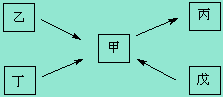 17.(共7分)
17.(共7分)
甲 、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如右图所示。
(1)若R为一种非金属元素,且上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,则由甲在一定条件下生成戊的化学方程式为 ,欲检验乙中官能团,所选用的试剂为(填序号) 。
① NaOH溶液 ② Br2的CCl4溶液 ③银氨溶液 ④ AgNO3溶液 ⑤ 稀HNO3
(2)若R为另一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 ;戊的稀溶液能跟过量铁粉反应,其离子方程式为 。
(3)若R为一种金属元素,乙由两种元素组成,甲溶液的pH小于7,单质丁在一定条件下可生成戊。甲与戊两种溶液混合生成沉淀丙的离子方程式为 ,除去镁粉中混有少量的丁,涉及的离子方程式为 。
18.(共9分)
有关元素X、Y、Z、D、E的信息如下
元 素
有关信息
X
元素主要化合价为?2,原子半径为0.074 nm
Y
所在主族序数与所在周期序数之差为4
Z
原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰
D
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子
E
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 。
(2)E元素与Y元素可形成 EY2 和 EY3 两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
⑤向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2Z的水溶液中各粒子的浓度关系,如c(Z2-)= 。
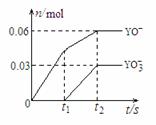 (4)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。该苛性钾溶液中KOH的质量是
,该反应中转移电子的物质的量是
。
(4)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。该苛性钾溶液中KOH的质量是
,该反应中转移电子的物质的量是
。
19.(共8分)
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
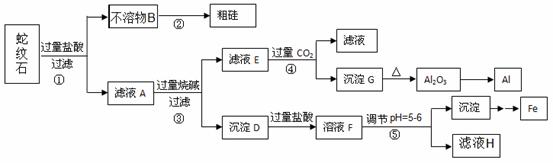
有关氢氧化物沉淀的pH见下表:
金属阳离子
氢氧化物开始沉淀时的pH
氢氧化物完全沉淀时的pH
Fe3+
1.9
3.2
Mg2+
9.4
11.6
(1)溶液A中含有的阳离子有 。
(2)操作②中涉及的化学方程式为 。
操作④中生成沉淀G的离子方程式为 。
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号) 。
a.NaOH溶液 b.氨水 c.MgO d.Mg (OH)2
(4)从滤液H制取金属Mg的流程如下:
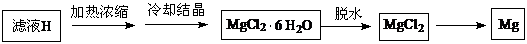
流程中冶炼镁的方法是 。在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是 。
20.(共11分)
用如下装置可以完成一系列实验(图中夹持装置已略去)。
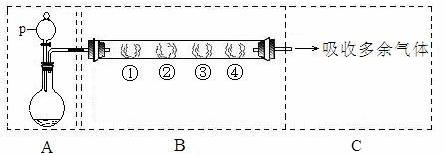
请回答下列问题:
I.(1)仪器p的名称是 。若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
B中棉花的位置
①
②
③
④
所蘸试剂
石蕊试液
品红溶液
淀粉和碘水混合液
氢硫酸
现象
褪色
浅黄色
体现SO2的性质
水溶液显酸性
漂白性
氧化性
(2)写出③中反应的离子方程式:
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂的化学式为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式 。①处包有的某固体物质可能是 。
a.MnO2
b.KMnO
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式: 。
21.(共9分)
某链烃A的分子式为C6H12,已知其分子中所有的碳原子共平面,且该分子的一氯取代物只有一种,回答下列问题:
(1)A的结构简式为 ;下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相同的是(填序号) 。
a.C7H12O2 b.C6H
(2)A与Br2的CCl4溶液反应生成B, B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学反应方程式: 。
(3)B与足量NaOH水溶液完全反应,生成有机物E。
①E可能发生的反应类型有(填序号) 。
a.取代反应 b.消去反应 c.加聚反应 d.还原反应
②E与乙二醇的关系是(填序号) 。
a.同分异构体 b.同系物 c.同一物质 d.同素异形体
(4)E与乙二酸在一定条件下生成分子式为C8H12O4的有机物,请写出该反应的化学反应方程式 。
(5)已知: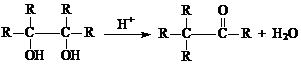 (-R为烃基),请写出E在酸性条件下生成G的化学反应方程式:
。与G分子式相同,能发生银镜反应,且结构中有两个甲基的异构体共有 种。
(-R为烃基),请写出E在酸性条件下生成G的化学反应方程式:
。与G分子式相同,能发生银镜反应,且结构中有两个甲基的异构体共有 种。
22.(共5分)
工业原料甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) 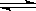 CO2(g)+3H2(g);△H > 0
CO2(g)+3H2(g);△H > 0
(1)一定条件下,向体积为
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) 。
 ① v正(CH3OH) = v正(CO2)
① v正(CH3OH) = v正(CO2)
② 混合气体的密度不变
③ 混合气体的平均相对分子质量不变
④ CH3OH、H2O、CO2、H2的浓度都不再发生变化
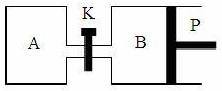
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度下,向A容器中充入1 mol CH3OH和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知,起始时容器A和B的体积均为a L。试回答:
① 反应达到平衡时,容器B的体积为1.
② 若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com