
2009年合肥市高三第一次教学质量检测化学试题
题 号
第Ⅰ卷
第Ⅱ卷
总分
三
四
五
得 分
(考试时间:90分钟 满分:100分)
相对原子质量:H:1 C:12 N:14 O:16 Na:23 K:39 Cu:64
Fe:56 Ba:137
第Ⅰ卷 (选择题 共44分)
题号
l
2
3
4
5
6
7
8
9
10
答案
题号
ll
12
13
14
15
16
17
18
答案
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)
1.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体HCl
D.废弃的PE、PVC均可回收利用以减少污染
2.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D。②④
3.下列有关实验的描述正确的是
A.氢氧化钠固体保存在配有橡皮塞的细口瓶中
B.将SO2通入品红溶液或KMnO4溶液均能使它们褪色,均可证明SO2有漂白性
C.不能在石英坩埚中熔化氢氧化钠
D.用湿润的pH试纸测定稀盐酸的pH
4.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.Cu和足量的稀硝酸反应产生
B.常温常压下,4.4gCO2和N2O的混合物中所含有的原子数为0.3N,
C.标准状况下,
D.在
5.生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述不正确的是
A.鱼虾放置时间过久,会产生不愉快的腥臭味,应当用水冲洗,并在烹调时加入少量食醋
B.“酸可以除锈”,“洗涤剂可以去油”都是发生了化学变化
C.被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注人了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛
D.苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固
6.一定能在下列溶液中大量共存的离子组是
A.水电离产生的c(OH-)=1×10-12mol?L”的溶液中:NH+、Na+、C1-、HCO3-
B.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的五色溶液中:ClO-、MnO4-、Al3+、SO42-
7.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层屯子数是内层电子总数的3倍。下列有关叙述正确的是
A.X肯定为碱金属元素
B.稳定性:Y的氢化物>Z的氢化物
C.X、Y两元素形成的化合物一定为离子化合物
D.Y、Z两元素形成的化合物熔点较低
8.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:
5KCIO3+6P=3P2O5+5KCl,则下列有关叙述错误的是
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.白色烟雾是生成的P2O5白色固体小颗粒(烟)吸收空气中的水分,生成磷酸小液滴(雾)
C.反应中消耗1molP时,转移电子的物质的量为5mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
9.盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:H2O(g)=H2O(l) △H2=-Q1kJ?mol-1
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ?mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H2=-Q3kJ?mol-1
若使
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5 Ql-1.5Q2+0.5Q3 D.1.5 Q1-0.5Q 2+0.5Q3
10.下列有关叙述正确的是
A.在AgCl悬浊液中,加人固体NaI,AgCl的质量不可能发生变化
B.用两铜棒做电极,电解稀H2SO4,电解初期主要化学方程式为
Cu+ H2SO4电解CuSO4+H2
C.钢柱在水下部分比在空气与水交界处更易腐蚀
D.
二、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确答案)
11.下列表达正确的是
A.常温下,pH=l的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存
B.乙烯、苯和乙醇都不能发生加成反应和加聚反应
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
D.醋酸与氢氧化钠溶液反应后,溶液显碱性,则溶液中各离子浓度一定存在如下关系 c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
12.铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,
这些气体与5.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成
硝酸。则消耗铜的质量为
A.
13.已知
×10-10mol?L-3。现向
则下列说法中正确的是
A,
B。KSP(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.以上说法均不正确
14.在密闭容器中通入A、B两种气体,在一定条件下反应:
△H<0;达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲
线的是
X
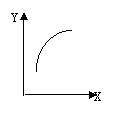 Y
Y
A
再加入B
B的转化率
B
再加入C
A的体积分数
C
增大压强
A的转化率
D
升高温度
混合气体平均摩尔质量
15.常温时,将a1mL,b1mol?L-1的CH3COOH溶液加入到a2mL,b2mol?L-1的NaOH溶液中,下列结论中不正确的是
A.如果a1b1=a2b2,则混合溶液的pH>7
B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=C(Na+)
C.如果al=a2,b1=b2,则混合液液中c(CH3COO-)=C(Na+)
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
16.能正确表示下列反应的离子方程式是
A.醋酸钾的水解反应 CH3COO-+H3O+=CH3COOH+H2O
B.碳酸氢钙与过量的NaOH溶液反应
Ca2++2HCO3-+2OH-=CaCO3 +2H2O+CO32-
C.苯酚钠溶液与少量的二氧化碳反应C6H5O-+CO2+H20=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO +4H2O
17.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2下,关于该反应的说法中,正确的是
A.该反应的氧化剂只有Cu2O
B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu既是氧化产物又是还原产物
D.每生成19.2gCu,反应中转移1.8mol电子
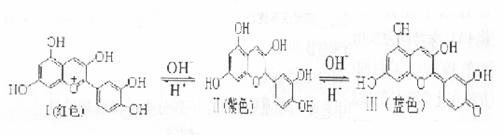 18.花青素(又称花色素)存在于植物花、果、叶、茎中,由于细胞液pH不同而呈现不同颜色。芙蓉花色素是一种花青素,它在不同pH条件下有以下三种存在形式:
18.花青素(又称花色素)存在于植物花、果、叶、茎中,由于细胞液pH不同而呈现不同颜色。芙蓉花色素是一种花青素,它在不同pH条件下有以下三种存在形式:
下列有关芙蓉花色素说法正确的是
A.由Ⅱ生成Ⅲ发生了氧化反应 B. I、Ⅱ和Ⅲ所有原子可能共平面
C.Ⅱ和Ⅲ互为同分异构体 D.可以用FeCl,溶液鉴别I、Ⅱ和Ⅲ
三、填空题(本题共3小题,19题11分,20题12分,21题11分,共34分)
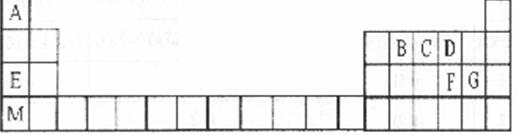 19.(11分)上表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。请回答下列问题:
19.(11分)上表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。请回答下列问题:
(1)B和F的最高价氧化物对应的水化物中酸性较弱的酸是 (填化学式),
写出可以验证该结论的一个离子反应方程式: 。
(2)写出C、G的氢化物相互反应所得产物的电子式 。
(3)D、F分别与A形成的化合物中沸点最高的化合物是 。
(填化学式),原因是 ;F原子的电子排布式为 。
(4)请将E+、F2-、G-、M+按半径由大到小排列 。
20.(12分)下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
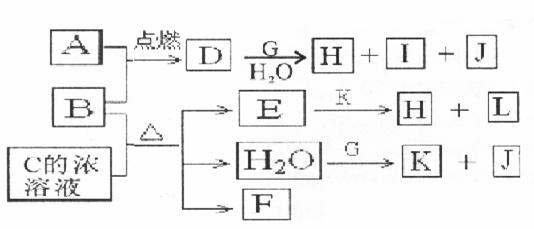 回答下列问题:
回答下列问题:
(1)K名称为 ,所含的化学键有 。
(2)①D的水溶液呈棕黄色,则D的水溶液与G反应的离子方程式为
②少量B与C浓溶液加热时反应的化学方程式为
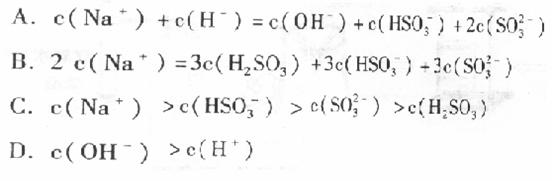 (3)①若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的下列关系式为
(填代号)。
(3)①若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的下列关系式为
(填代号)。
②若将标准状况下2.24L的F通人150mL,lmol?L-1的K溶
液中。则所得溶液中各粒子浓度关系满足的上列关系式为 (填代号)。
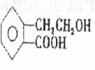
21.(11分)有机物A的结构简式为:OH,它可通过不同化
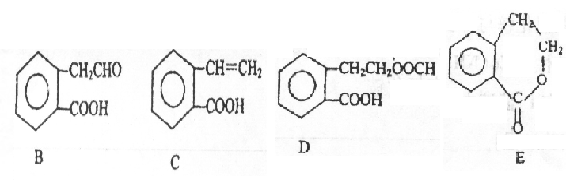 学反应分别制得B、C、D和E四种物质。
学反应分别制得B、C、D和E四种物质。
请回答下列问题:
 (1)指出反应的类型:A C:
。
(1)指出反应的类型:A C:
。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式 。
(4)C知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填代号)。
(5)C能形成高聚物,写出C生成其高聚物的化学方程式 。
(6)写出D与Na0H溶液共热反应的化学方程式 。
四、实验题(12分)
22.(12分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物。所示实验:
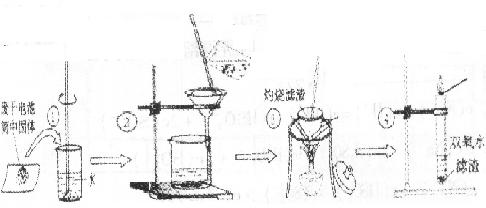
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、泥三角、三角架、 ;
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,自此推测滤渣中含有MnO:,写出试管中发生反应的化学方程式: ; MnO2的作用是――
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,
由此推测滤渣中除含有Mn02外,还存在的黑色物质为
(4)已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀
氨水生成可溶性的Zn(NH3)4(OH)2:该同学设计如下实验探究②中所得滤液
中的溶质
[探究1]滤液中含有氯化铵
[实验过程]
[实验现象]有刺激性气味气体逸出
写出该离子方程式
[探究2]滤液中含有氯化锌
[实验过程] [实验现象]
由上述现象得出结论:滤液中含有氯化锌和氯化铵。
五、计算题(10分)
23.(10分)数据分析能力是新课程中对学生提出的一项要求。下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
实验
次数
称取样品
的质量/g
所加Ba(OH)2
溶液的体积/L
测得生成
沉淀质量/g
1
0.518
0.5
0.985
2
1.036
0.5
3
1.554
0.5
2,955
4
2.072
0.5
3.940
5
2.590
0.5
3.940
6
3.108
0.5
3.940
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀质量是多少克,请将结果填在表格相应空格中;
(2)样品中KHCO3和Na2CO3的物质的量之比是 ;
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05moL/L的盐酸,反应后所得溶液的pH=2,求出所加盐酸的体积(溶液混合时不考虑体积变化,写出计算过程)。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com