2008年秋季湖北省黄冈中学高一化学期末考试试题
本试卷分第Ⅰ卷和第Ⅱ卷共108分,考试时间90分钟
可能用到的相对原子质量是:H:1 C:12 O:16 Na:23 Cl:35.5 K:39
Ca:40 Mn:55 Fe:56 Br:80
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,每小题2分,每小题只有一个选项符合题意)
1.著名化学家、诺贝尔化学奖获得者Glenn Theodore Seabory1979年在美国化学会成立100周年大会上指出:“化学,是人类进步的关键!”。学习和研究化学是为了更好的认识世界。下列涉及的内容一般不属于化学研究范围的是
A.研究一种新材料的性质和用途 B.研究一种新微粒的组成和结构
C.研究一种新药品的合成
D.研究一种新物质的运动规律
试题详情
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是
试题详情
A.标准状况下,22.4L水含有NA个水分子
B.氧气和臭氧的混合物32 g中含有NA个氧原子
试题详情
C.7.8 g Na2O2与水反应时转移0.1NA个电子
试题详情
试题详情
3.关于Na+和Na的性质叙述正确的是
A.都具有金属光泽 B.都是强还原剂
C.焰色反应现象相同 D.电子层结构相同
试题详情
4.实验室制取下列各组气体,所用气体发生装置相同的是
A.氢气和二氧化碳
B.氢气和氧气
C.氯气和氧气
D.氯气和氢气
试题详情
5.下列物质用途不正确的是
A.溴化银可用于制胶片和有色玻璃 B.过氧化钠可用于漂白织物、羽毛等
试题详情
C.碘化银可用于人工降雨 D.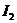 可以用于配制含碘食盐
可以用于配制含碘食盐
试题详情
二、选择题(本题包括8小题,每题3分,共24分.每小题有一至两个选项符合题意.只有一个正确选项的,多选不给分.有两个正确选项的,选对一个给1分,选错一个不给分)
6.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象
和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C.加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在
试题详情
7.下列各组溶液中,不用任何其它试剂即可鉴别的是
A.HF、HCl、HBr、HI
B.KMnO4、CuCl2、FeCl3,NaCl
C.KNO3、KI、AgNO3、Na2CO3 D.溴水、NaCl、NaBr、KI
试题详情
8.下列离子方程式的书写中正确的是
A.等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.在次氯酸中加入碳酸钠:2HClO+CO32-=2ClO-+H2O+CO2↑
C.钾与水反应:2K+2H2O=2K++2OH-+H2↑
D.氯化钠溶液中通入氟气:F2+2Cl-=2F-+Cl2↑
试题详情
9.一辆载有约35吨液氯的槽罐车与一辆货车相撞,导致槽罐车中液氯大面积泄漏,造成多人伤亡。下列处理方法和过程合理的是
A.将人群转移到地势较低的地方,等待营救
B.将槽罐车推入附近的水塘中,撒上石灰
C.用高压水枪向空中喷洒大量浓氨水溶液
D.被转移人群可戴上用NaOH处理过的口罩
试题详情
10.比较是化学学习中的一种重要方法。下列各组比较中不正确的是
A.在相同条件下的溶解度:NaHCO3>Na2CO3
B.热稳定性:HF>HCl>HBr>HI
C.氧化性:F2> Cl2 > Br2 >I2
D.碳酸钠溶液与稀盐酸互滴时,两种操作现象相同
试题详情
11.为除去括号内的杂质,所选用的试剂或方法不正确的是
A.Na2CO3粉末(NaHCO3),加热直至固体质量不再减少
B.NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体
C.CO2 (HCl),将气体依次通过Na2CO3溶液和浓硫酸中
D.H2 (HCl),将气体通入碱石灰中
试题详情
12.下列相关卤素的叙述正确的是
A.卤素离子(X-)只有还原性而无氧化性
B.某元素由化合态变成游离态,该元素一定被氧化
C.失电子难的原子获得电子的能力一定强
D.卤素最高价氧化物的分子式都为X2O7
试题详情
13.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色
D.Ⅳ中溶液不分层,溶液由棕黄色变成黄绿色
试题详情
三、选择题(本题包括5小题,每小题3分,共15分,只有一个选项符合题意)
14.甲、乙、丙三种液各含有一种X-(Cl-、Br-、I-)。 向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有
A.Br-、Cl-、I-
B.Br-、I-、Cl-
C.I-、Br-、Cl-
D.Cl-、I-
、Br-
试题详情
15.据报导,在全国各地发生过多次因混合洁污剂引起氯气中毒的事件。据此推测相混合的洁污剂中最有可能含
A.ClO4-、Cl-、Na+ B.ClO-、Cl-、H+ C.NaClO、NaClO3 D.NaClO、NaCl
试题详情
16.用1L1mol?L-1的NaOH溶液吸收0.8molCO2,所得溶液中,CO32-和HCO3-的物质的量浓度之比约为
A.1∶3 B.2∶1 C.2∶3 D.3∶2
试题详情
17.某溶液中Cl-、Br-、I-三者物质的量之比为2┱3┱4,要使溶液中Cl-、Br-、I-物质的量之比为1┱1┱1,则通入Cl2的物质的量是原溶液中I-物质的量的
A.1/2 B.1/3 C.1/4 D.1/8
试题详情
18.在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是
试题详情
A.0.5mol
Na2CO3和1mol
NaOH B.1mol
Na2CO3和0.6mol
NaOH
试题详情
C.0.8mol
Na2CO3和1mol
NaOH D.只有1mol Na2CO3
第Ⅱ卷(非选择题,共59分)
试题详情
四、实验题(本题包括2小题,共17分)
19.(9分)某NaCl样品中混有NaBr杂质,为了测定该NaCl样品的纯度,设计的实验过
程如下图所示:
试题详情
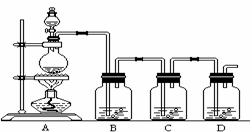 (1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格内填写装置中所放的化学药品。
(1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格内填写装置中所放的化学药品。
A
→
B
→
C
→
D
溶液甲
(2)萃取所需要的主要玻璃仪器是_______________;
(3)溶液甲中通入Cl2的化学方程式为
;
(4)原固体样品中氯化钠的质量分数为__________________。
试题详情
20.(8分)利用Na2O2与水反应能放出氧气的性质,可通过选择装置A或B来测定已部分变质的Na2O2样品中Na2O2的质量分数。
|
|
|
|
|
|
H2O H2O
|
|
|
|
|
|
|
|
|
|
Na2O2O
Na2O2O
A B (1)实验室提供的是500mL量筒,则实验中取用Na2O2样品的质量最合适的是_______。
试题详情
A.0.1~0.2g
B.2.5~3.0g C.5.0~6.0g D.10~15g (2)如图托盘天平称取样品,应选用下图中的_________(填①或②)。不选用另一装置的原因是_______________。
① ② (3)因Na2O2与水反应会放热而影响测定的准确性,所以反应结束后,必须使锥形瓶中的气体温度恢复至室温,应选用装置A、B中的
(填A或B)。如果选用了另一种不适当的装置,测得的Na2O2的质量分数会
(填偏大或偏小)。 (4)如在实验中,气体摩尔体积为a L?mol-1,量筒中收集到的水的体积为V mL,样品的质量为m g,则样品中Na2O2的质量分数为
。 五、填空题(本题包括4小题,共30分)
试题详情
21.(6分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一, 漂白粉是常用的消毒剂。 (1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为:
; (2)漂白粉的有效成分是(填化学式)
; (3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,其反应化学反应方程式为:
; (4)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加几滴酚 酞试液,开始时溶液呈红色,这说明漂白粉溶液呈
性。 试题详情
22.(8分)A、B、C、D、E五种物质的焰色都呈黄色,A、B与水反应都有气体放出,A 与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。 (1)写出下列物质的化学式: B
,E
。 (2)写出A→C的化学方程式,并标出电子转移的方向和数目:
。 (3)写出C→D的离子方程式:
。 试题详情
(4)写出化学方程式:E+B D+C+O2↑:
。 D+C+O2↑:
。 试题详情
23.(11分)已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈
装置(c) 装置(b) 装置(a) (1)请根据以上关系进行判断,指出下列物质的化学式: A
,C
,D
,G
. (2)写出下列反应的化学方程式: C+D:
; A+B:
。 在A和B的反应中,A显示出来的性质是
(填写序号,多选倒扣)。 ①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性 当A和B进行反应时,应选择上图所示装置中的
较为合适。 (3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为
。
试题详情
24.(5分)在含有nmolFeBr2的溶液中,通入氯气,有xmolCl2发生反应。 (1)当x≤n/2时,反应的离子方程式为_________________________________________。 (2)当反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-时,x与n的关系是:_____。 (3)当Fe2+和Br-同时被氧化时,x与n的关系是________。 (4)当x =n时,反应后氧化产物的量为_______。 六、计算题(本题包括2小题,共12分) 试题详情
25.(6分)0.92g金属钠与水反应后,得100 mL溶液,求(1)生成的气体在标准状况下的 体积;(2)反应后所得溶液物质的量浓度。 试题详情
26.(6分)用适量MnO2和10 mol/L的盐酸120mL(过量)反应制取Cl2,若反应过程中有 试题详情
0.2mol电子发生转移,求:(1)生成标准状况下Cl2的体积;(2)被氧化的HCl占原有HCl的物质的量百分数。 湖北省黄冈中学2008年秋季高一化学期末考试试题答题卡 第Ⅰ卷(选择题,共49分) 题号 1 2 3 4 试题详情
 5 5
6 7 8 9 答案 题号 10 11 12 试题详情
 13 13
14 15 16 17 18 答案 第Ⅱ卷(非选择题,共59分) 试题详情
20.(9分) A → B → C → D 溶液甲 (2)
; (3)
; (4)__________________。 试题详情
19.(8分) (1)___________; (2)___________, __________________________________________________________。 (3)___________,___________;
(4)__________________。 试题详情
21.(6分) (1)
; (2))
; (3)
; (4) 。 试题详情
22.(8分) (1)B
, E
; (2)
; (3)
; (4)
。 试题详情
23.(11分) (1)A
,C
,D
,G
; (2)C+D:
, A+B:
,
, ; (3)
。 试题详情
24.(5分) (1)_________________________________________; (2)
; (3)
; (4)
。 试题详情
试题详情
试题详情
题号 1 2 3 4  5 5
6 7 8 9 答案 D C C A D B BC C B 题号 10 11 12  13 13
14 15 16 17 18 答案 AD C A B B B A D B 19.(9分) (1)A MnO2 浓盐酸 B 饱和食盐水 D NaOH溶液 (2)分液漏斗 (3)2NaBr+Cl2=2NaCl+Br2 (4)90% 20.(8分) (1)B (2)① 过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量,并且过氧化钠为粉末状不易全部转移到锥形瓶中。 (3)A 偏大 (4) 21.(6分) (1)2Cl2+2Ca(OH)2
= CaCl2+Ca(ClO)2+2H2O
(2)Ca(ClO)2
(3)Ca(ClO)2 + CO2 + H2O == CaCO3↓+
2 HClO
(4)碱性  22.(8分)(1)B:Na2O2 E:NaHCO3; 22.(8分)(1)B:Na2O2 E:NaHCO3;
(2)2Na+2H2O=2NaOH+H2↑。 (3)CO2+2OH-=CO32-+H2O。 (4)2NaHCO3+2Na2O2 2Na2CO3+2NaOH+O2↑。 2Na2CO3+2NaOH+O2↑。 23.(11分) (1)A.HCl(或浓HCl)
C.Cl2 D.KBr G.KI
(2)C+D:Cl2+2KBr=2KCl+Br2 ;A+B:4HCl+MnO2 MnCl2+Cl2↑+2H2O;②;C MnCl2+Cl2↑+2H2O;②;C (3)5:1 24.(5分)(1)2Fe2++Cl2=2Fe3++2Cl-; (2)2x=3n; (3)x>;(4)1.5n。 25.(6分)(1)0.448L(448mL) (2)0.4mol/L 26.(6分)(1)2.24L
(2)16.7%
| | | | | | | |

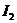 可以用于配制含碘食盐
可以用于配制含碘食盐 (1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格内填写装置中所放的化学药品。
(1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格内填写装置中所放的化学药品。