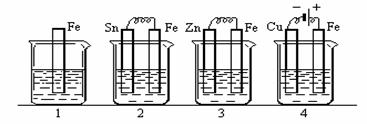
|
试题详情
14.有一种有机物结构简式为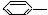 CH=CH2 推测它不可能具有下列哪种性质 CH=CH2 推测它不可能具有下列哪种性质 A.能被酸性高锰酸钾溶液氧化 B.能与溴水发生加成反应褪色 C.能发生加聚反应
D.易溶于水,也易溶于有机溶剂 试题详情
试题详情

A.(1)(2)中Mg作负极,(3)(4)中Fe作负极 B.(2)中Mg作正极,电极反应式为: 6 H2O +6e―=6OH―+3 H2↑ C.(3)中Fe作负极,电极反应式为: Fe一2e―=Fe2+ D.(4)中Cu作正极,电极反应式为: 2H++2e―=H2↑ 试题详情
16.用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设 电解时温度不变且用惰性电极,下列说法不正确的是 试题详情
A.当电池负极消耗 气体时,电解池阴极有 气体时,电解池阴极有 气体生成 气体生成 B.电解池的阳极反应式为:4OH--4e-==2H2O+O2↑ 试题详情
C.电解后, 不变,且溶液中有晶体析出 不变,且溶液中有晶体析出 试题详情
D.电池中 不变;电解池中溶液 不变;电解池中溶液 变大 变大 试题详情
17.由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O
7L(所有体积 都在120℃测定),则这两种混合气体的可能组成是 A.C2H4、C3H8 B.CH4、C5H8 C.CH4、C4H8
D.C2H6、C3H8 试题详情
18.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在 试题详情
充电和放电时发生的反应:Fe+NiO2+2 H2O Fe(OH)2+Ni(OH)2 Fe(OH)2+Ni(OH)2 下列有关对爱迪生蓄电池的推断错误的是
A.放电时,Fe是负极,NiO2是正极 B.充电时,阴极上的电极反应式为Fe(OH)2+2e-====Fe+2OH- C.放电时电解质溶液中的阴离子是向正极方向移动 D.蓄电池的电极必须浸入碱性电解质溶液中 试题详情
19. 0.3 mol硼烷(B2H6)在氧气中完全燃烧生成B2O3固体和液态水,放出649.5 kJ热量。 下列判断正确的是 A.该反应是非氧化还原反应 B.在理论上可以利用该反应的原理做成燃料电池 试题详情
C.该反应的热化学方程式为:B2H6(g)+3O2(g)
= B2O3(s) +3H2O(l); H= +2165 kJ/mol H= +2165 kJ/mol D.每生成18 g水,该反应转移2 mol电子 试题详情
20.在25℃、1.01×105Pa下,将22 g CO2通入1 mol?L-1NaOH溶液750mL中充分反应, 测得反应放出x kJ热量。在该条件上,1 mol CO2通入2
mol?L-1NaOH溶液1 L中充分 反应放出y
kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是 A.CO2(g)+NaOH(aq)
=== NaHCO3(aq);△H=-(2y-x) kJ?mol-1 B.CO2(g)+NaOH(aq)
=== NaHCO3(aq);△H=-(2x-y) kJ?mol-1 C.CO2(g)+NaOH(aq) ===
NaHCO3(aq);△H=-(4x-y) kJ?mol-1 D.2CO2(g)+NaOH(1) === NaHCO3(1);△H=-(8x-2y) kJ?mol-1 第Ⅱ卷(共40分) 试题详情
二、填空题(本题共6小题,共40分) 21.(某溶液中可能含有下列离子中的两种或几种:Ba2+、H+、SO42-、 SO32- 、HCO3-、 Cl-。 (6分)(1)当溶液中有大量H+存在时,则不可能有
离子存在。 (2)当溶液中有大量Ba2+存在时,溶液中不可能有
离子存在。 (3)采用惰性电极从上述离子中选出适当离子组成易溶于水的电解质,对其溶液进行 电解若两极分别放出气体,且体积比为1∶1,则电解质化学式是________________。 试题详情
22.(4分)某烃类化合物A的相对分子质量为84,分子中含有一个碳碳双键,其分子中只有 一种类型的氢原子。(1)A的结构简式为
; (2)A中的碳原子是否都处于同一平面?
(填“是”或者“不是”)。 试题详情
23.已知下列两个热化学方程式:H2(g)+1/2O2(g)==H2O(l);△H=
― 285.8KJ/mol, 试题详情
(8分)
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l);△H=
―2220.0KJ/mol, ⑴H2的燃烧热为
。 试题详情
⑵实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态的水时放热6264.5KJ, 则混合气体中H2和C3H8的体积比是
。 ⑶1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为:
。 ⑷ 已知 H2O(l)==H2O(g)
△H= +44KJ/mol 写出丙烷燃烧生成CO2和 气态水的热化学方程式:
。 试题详情
24.(2分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法 直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: 试题详情
Fe2O3(s)+3CO(g)==
2Fe(s)+3CO2(g) △H=
?24.8kJ/mol 试题详情
3Fe2O3(s)+
CO(g)==2Fe3O4(s)+ CO2(g) △H=
?47.2kJ/mol 试题详情
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)
△H= +640.5kJ/mol 写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: _________________
试题详情
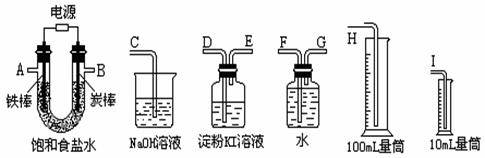 25.(8分)现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积约 25.(8分)现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积约
6mL和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序是: (填编号)A接__________________________,B接__________________________;
(2)铁棒接直流电源的________极;炭棒上发生的电极反应为
。
(3)能说明氯气具有氧化性的实验现象是_________________________________ _;
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为 试题详情
5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的c(OH―)约为_____。 怀宁中学高二化学试题答题卷 试题详情
二、填空题(本题共6小题,共40分)
试题详情
22.(4分)(1)A的结构简式为
;(2)
(填“是”或者“不是”)。 试题详情
23.(8分) ⑴H2的燃烧热为
。⑵体积比是
。 ⑶热量为:
。 ⑷热化学方程式:
。 试题详情
24.(2分)热化学反应方程式:
_________________
试题详情
25.(8分) (1)(填编号)是: A接_________________, B接_________________;
(2)铁棒接直流电源的________极;炭棒上发生的电极反应为
。
(3)现象是_________________________________ ___________________________
;
(4)c(OH―)约为________________。 试题详情
26.(12分)(1)
,
。 (2) ,
。 (3) ,
。 (4)G:
;H:
。 试题详情
26.(12分)A、B、C、D四种芳香族化合物的结构简式如下所示: 试题详情
 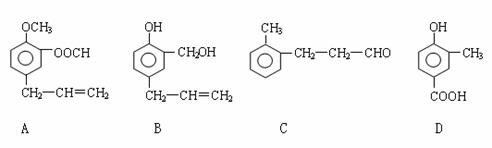
请回答下列问题: (1)写出A中无氧官能团的名称
,C中含氧官能团的结构简式为
。 (2)用A、B、C、D填空:能发生银镜反应的有
,既能与FeCl3溶液发生 显色反应又能与Na2CO3溶液反应放出气体的是
。 (3)按下图C经一步反应可生成E,E是B的同分异构体, 试题详情
则反应①的反应类型为
,写出反应②的化学方程式:
。 (4)G、H和D互为同分异构体,它们具有如下特点: ① G和H都是苯二元取代物,这两个取代基分别为羟基和含有-COO-结构的基团; ② G和H苯环上的一氯代物有两种不同结构; ③ G可以发生银镜反应,H分子中苯环不与取代基碳原子直接相连 。 写出G和H的结构简式:G:
;H:
。 怀宁中学2008-2009学年度上学期期末高二化学试题答案 1 2 3 4 5 6 7 8 9 10 D B A B A D C D B A 11 12 13 14 15 16 17 18 19 20 A B C D B D D C B C 试题详情
二.填空题(共40分) 21.(6分)(1) SO32- 、HCO3-
(2)SO42-、 SO32-
(3) HCl、BaCl2 试题详情
22. (4分)(1) (2)是。 (2)是。 试题详情
23. (8分)(1)285.8KJ/mol (2)1:1 (3)4725.8KJ
(4)C3H8(g)+5O2(g)==3CO2(g)+4H2O(g);△H=
―2044KJ/mol 试题详情
24.(2分)
CO(g)+FeO(s) == Fe(s)+CO2(g) △H=?218.0kJ/mol 试题详情
25..(8分)(1)G、F、I; D、E、C ; (2)负 2Cl??2e?=Cl2↑ (3)淀粉―KI溶液变成蓝色; (4)10-2mol/L 试题详情
26.(12分)(1)碳碳双键,?CHO (2)A、C ; D 试题详情
(3)氧化,  试题详情
试题详情
| 
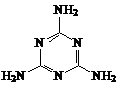 4.三聚氰胺俗称蜜胺,主要用于生产三聚氰胺一甲醛树脂。三聚氰胺微溶于冷水,易结晶,可溶于热水,低毒。在一般情况下较稳定,但在高温下可能会分解放出氰化物。其结构式如右图,下列有关说法不正确的是
4.三聚氰胺俗称蜜胺,主要用于生产三聚氰胺一甲醛树脂。三聚氰胺微溶于冷水,易结晶,可溶于热水,低毒。在一般情况下较稳定,但在高温下可能会分解放出氰化物。其结构式如右图,下列有关说法不正确的是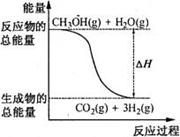 8. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
8. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是