|
试题详情
10.根据下列短周期元素性质的数据判断,下列说法正确的是 试题详情
 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 原子半径/10-10 m 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
1.18 最高或最低化合价 +2 +1 +5 +7 +1 +5 +3 -2 -3 -1 -3 A.元素①⑧形成的化合物具有两性 B.元素⑦位于第二周期Ⅴ族 C.元素④⑤形成的化合物是离子化合物 D.元素③的最高价氧化物对应水化物碱性最强 试题详情
试题详情
 A.硫化钠的水解反应:S2-+H3O+ A.硫化钠的水解反应:S2-+H3O+ HS-+H2O HS-+H2O
B.用铜做阳极电解氯化铜溶液:Cu2++2Cl-
Cu+Cl2↑ C.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O D.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 试题详情
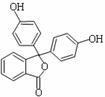 12.酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示。 12.酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示。
下列对该有效成分的说法正确的是 A.所有原子可能共平面 B.核磁共振氢谱中有7个峰 C.能发生加聚反应生成高分子化合物 D.1 mol该物质最多能与含3
molNaOH的烧碱溶液反应 试题详情
13.常温下0.2mol/L HCN和0.1mol/L NaOH等体积混合后溶液pH>7,混合溶液中有关粒子物质的量浓度关系正确的是 A.c(HCN)+c(CN-)=c(Na+)
B.c(HCN)+2c(H+)=2c(OH-)+c(CN-) C.c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+) D.c(HCN)>c(CN-)>c(Na+)>c(H+)>c(OH-) 试题详情
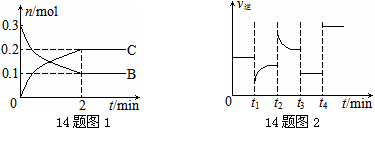 14.一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) 14.一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。 xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
下列有关说法正确的是 试题详情
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L?min) B.t1时改变的条件是降温,平衡逆向移动 C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大 D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变 试题详情
三、非选择题(本题包括6小题,共60分) 15.(10分)凯氏定氮法测定奶粉中蛋白质含量的步骤如下: 试题详情
  ① 样品处理:准确称取奶粉试样1.000 g置于烧瓶中,加入足量不含氮元素的试剂A,一定条件下充分反应,产物用水溶解并冷却后全部转移至100 mL容量瓶中定容。 ① 样品处理:准确称取奶粉试样1.000 g置于烧瓶中,加入足量不含氮元素的试剂A,一定条件下充分反应,产物用水溶解并冷却后全部转移至100 mL容量瓶中定容。
试题详情
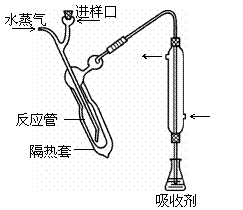
② 碱化蒸馏:量取容量瓶中溶液10.00 mL转移至右图所示的 反应管中,再加入足量NaOH溶液,塞好进样口橡皮塞。 通入高温水蒸气。用吸收剂吸收产生的气体。 试题详情
③ 滴定:向吸收气体后的溶液中滴加2滴指示剂,用0.01 mol/L HCl标准溶液滴定至终点。 已知: 吸收剂中发生的反应为:NH3+4H3BO3=NH4HB4O7+5H2O; 滴定时发生的反应为:NH4HB4O7+HCl+5H2O=NH4Cl+4H3BO3。 根据以上知识回答下列问题: ⑴ 样品处理的目的是 ▲ ;通入高温水蒸汽的作用除加热外,还有 ▲ 。 ⑵ 冷凝管的作用是冷凝、导气、 ▲ 。 试题详情
⑶ 若蛋白质中氮元素的平均含量为16.0 %,滴定终点时消耗盐酸标准液15.50 mL,则该奶粉中蛋白质的含量为 ▲ %。 ⑷ 凯氏定氮法测定奶粉中蛋白质含量灵敏度高,操作简单,缺点是 ▲ 。 试题详情
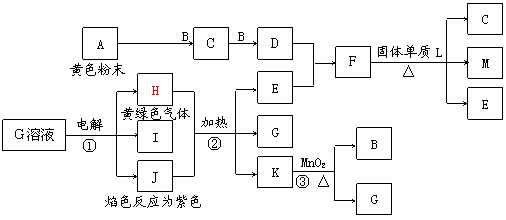 16.(8分)下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。 16.(8分)下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。
请回答下列问题:
⑴ C的分子式为 ▲ ,J的电子式为 ▲ 。 ⑵ 写出反应①的离子方程式 ▲ 。 ⑶ 写出反应②的化学方程式 ▲ 。 ⑷ C、M有相似的化学性质,但也有区别,如C有漂白性、M五漂白性。 C、M具有其他不同化学性质的原因是 ▲ 。 试题详情
试题详情
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网。请回答下列问题: ⑴ 1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下: 试题详情
试题详情
 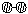 、 、 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 ▲ 。 、 、 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 ▲ 。
试题详情
⑵ 合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g),写出该反应的化学平衡常数表达式K= 2NH3(g),写出该反应的化学平衡常数表达式K= ▲ 。在一定温度和压强下,将H2和N2按3∶1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为 ▲ 。 试题详情
⑶ 已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.8
kJ/mol 试题详情
N2(g)+O2(g)=2NO(g) △H=+180.5
kJ/mol 氨催化氧化的热化学方程式为 ▲ 。 ⑷ 吸收塔中通入空气的目的是 ▲ 。 试题详情
18.(10分)减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下: 试题详情
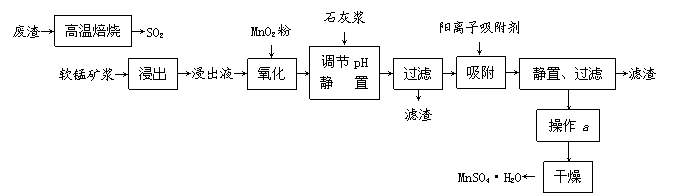
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。 有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。 离子 离子半径(pm) 开始沉淀时的pH 完全沉淀时的pH Fe2+ 74 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情

已知PbO2的氧化性大于MnO2。请回答下列问题: ⑴ 写出浸出过程中主要反应的化学方程式 ▲ ,氧化过程中主要反应的离子方程式 ▲ 。 ⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 ▲ 。 ⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是 ▲ (填写序号)。 a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间 ⑷ 操作a包括 ▲ 等过程。 试题详情
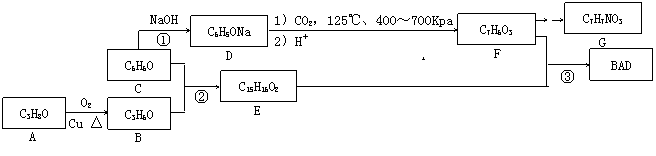 19.(12分)BAD是一种紫外线吸收剂,其合成方法如下: 19.(12分)BAD是一种紫外线吸收剂,其合成方法如下:
已知: 试题详情
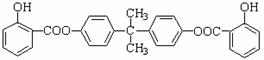 Ⅰ、B分子中所有H原子的化学环境相同; Ⅰ、B分子中所有H原子的化学环境相同;
Ⅱ、BAD的结构为:
。
请回答下列问题:
⑴ A的名称为 ▲ 。 ⑵ F的结构简式为 ▲ 。F的一些同分异构体能使氯化铁溶液变色,能发生银镜反应,且苯环上的一硝基取代产物有两种。符合上述条件的同分异构体有 ▲ 种。 ⑶ 反应②的化学方程式为 ▲ ;反应③在一定条件下能直接进行,其反应类型为 ▲ 。 ⑷ G是一种氨基酸,且羧基和氨基处于苯环的对位。写出G缩聚产物可能的结构简式 ▲ (只要求写一种)。 试题详情
20.(10分)漂白粉常用作消毒剂、杀菌剂、漂白剂等。工业上是把氯气通入含水略少于1 %(质量分数)的消石灰中制得漂白粉。漂白粉是一种混合物,其有效成分是Ca(ClO)2,商品漂白粉中往往含有Ca(OH)2、CaCl2、H2O等杂质。漂白粉质量高低由“有效氯”(过量浓盐酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)和它保持有效氯的时间来决定的。 试题详情
⑴ 现称取某漂白粉4.00 g配制成500 mL溶液,准确吸取其中25.00 mL后,加入足量的足量浓盐酸和KI溶液,静置。待反应产生的氯气与KI完全反应后,用0.100 mol/L的Na2S2O3溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI),到达终点时消耗20.00 mLNa2S2O3溶液。计算该漂白粉中有效氯的百分含量。 ⑵ 某研究性学习小组用上述方法测得一种漂白粉的有效氯为56%。请根据推理和计算判断该实验结果是否准确。 ⑶ 某品牌漂白粉的组成可表示为Ca(OH)2?3CaCl(OCl)?nH2O,有效氯为35%,n= ▲ 。 下列A、B两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。 试题详情
四、选做题(本题包括1小题,共12分) 21.(12分) A.空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。 请回答下列问题: ⑴ S、N、O的第一电离能由大到小的顺序为 ▲ 。 ⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。 ① 写出亚铁离子的基态电子排布式 ▲ 。 试题详情
 ② CO有多种等电子体,其中常见的两种为 ▲ 。 ② CO有多种等电子体,其中常见的两种为 ▲ 。
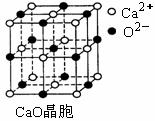
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在 燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+的配位 数为 ▲ ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分 别为:CaO-3 401kJ/mol、NaCl-786kJ/mol。CaO晶体的熔点 ▲ NaCl 晶体的熔点(填“高于”、“等于”或“低于”)。 ⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来 试题详情
越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要 试题详情
有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: ▲ 。 B.某校研究性学习小组拟利用分光光度法对空气中二氧化硫含量(mg/m3)进行测定。分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单的用公式表示为A=kc,其中A为吸光度,k为一定条件下的常数,c为溶液浓度。 实验步骤如下: 试题详情
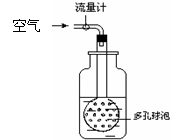 ⑴
采样: ⑴
采样:
① 如果你是该小组成员,你对采样的地点和时间有何建议: ▲ 。 ② 用右图装置采样,通过50L空气后,将吸收液移入100ml容量瓶,用少量吸 收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不 用导管的原因是 ▲ 。 ⑵ 吸光度与SO2含量标准曲线的绘制:在6支25ml比色管中,用每毫升含25μg 二氧化硫的标准液配置下表标准SO2含量系列。 二氧化硫标准系列 管 号 0 1 2 3 4 5 标准液(ml) 0 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
25.00 用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。 管 号 0 1 2 3 4 5 吸光度 0 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
 请在右图所示的坐标系中绘制标准曲线: 请在右图所示的坐标系中绘制标准曲线:
⑶ 准确量取容量瓶中溶液10mL加入比色皿,测得其吸光度值 试题详情
为0.10,则空气中二氧化硫含量为 ▲ mg/m3。我国环境空气 质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3): 试题详情
一级标准:0.15;二级标准:0.50;三级标准:0.70。 则该市空气为 ▲ 级标准。 ⑷ 甲、乙两组同学测定结果相差较大,乙组同学测定空气中SO2 含量偏小,试分析乙组同学出现误差的可能原因: ▲ (两个所用 药品和装置均无问题)。 南通市2008~2009年度第一学期高三期末调研测试 试题详情
一、单项选择题(本题包括8小题,每题3分,共24分。) 1.D 2.A 3.B 4.C 5.A 6.D 7.C 8.B 二、不定项选择题(本题包括6小题,每小题4分,共24分。) 9.AB 10.A 11.CD 12.BD 13.BC 14.D 三、非选择题(本题包括6小题,共60分) 15.(10分) ⑴ 将奶粉中氮元素全部转变为NH4+ 使反应中生成的氨气全部进入吸收液 ⑵ 防止倒吸 ⑶ 13.6 ⑷ 无法确定氮元素是否一定来自于蛋白质 16.(8分)
电解 ⑵ 2Cl-+2H2O=2OH-+Cl2↑+H2↑ 
⑶ 3Cl2+6KOH 5KCl+KClO3+3 H2O ⑷ SO2中S为+4价,是中间价态,既有还原性又有氧化性,而CO2中C为+4价,只有氧化性 17.(10分) ⑴ 图②表示N2、H2被吸附在催化剂表面,图③表示在催化剂表面,N2、H2中化学键断裂 ⑵ K= 26% 26% ⑶ 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol ⑷ 使NO循环利用,全部转化成HNO3 18.(10分) ⑴ SO2+MnO2=MnSO4 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ⑵ 4.7~8.3 ⑶ b
c d ⑷ 蒸发浓缩结晶 19.(12分) ⑴ 2-丙醇 
⑵3

⑶ CH3COCH3+2 → H2O+ 取代反应 → H2O+ 取代反应 
⑷ 20.(10分) ⑴ 根据反应原理知,n(Cl2)=n(I2)= n(Na2S2O3)= n(Na2S2O3)= ×0.100 mol/L×0.020L=0.001mol ×0.100 mol/L×0.020L=0.001mol 有效氯= =35.5% =35.5% ⑵ 不合理。即使漂白粉仅含Ca(ClO)2和CaCl2,有效氯的最大值为 ×100%=56%。事实上,漂白粉制备时加了水,且漂白粉还含有其他物质。 ×100%=56%。事实上,漂白粉制备时加了水,且漂白粉还含有其他物质。 ⑶ 8.53 四、选做题(本题包括1小题,共12分) 21.(12分) A.⑴ N>O>S ⑵ ① 1s22s22p63s23d6 ② N2、CN-
⑶
6 高于 ⑷
甲醇分子间存在氢键,而甲醛没有 B.⑴ ① 在不同地点、不同时间采样,如学校、工厂、居民区附近;早晨、中午、晚上分别采样  ② 使二氧化硫能被吸收液充分吸收 ② 使二氧化硫能被吸收液充分吸收
⑵ (见右图) ⑶ 0.5
二级标准 ⑷ 抽气速率过快,造成空气中SO2与吸收液未充分反应,产生较大误差
| | | 
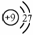
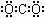
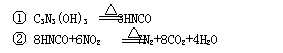
 ”转化关系的一组是
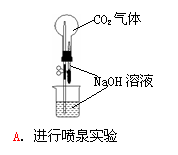
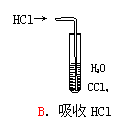
”转化关系的一组是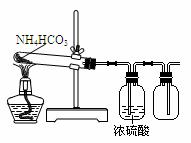 9.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
9.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是