1,3,5 A.人体体液的pH必须维持在一定范围内,pH过大会造成“碱中毒” B.食品添加剂都对健康有害,应禁止使用 C.人体缺钙会引起骨质疏松症,因此钙元素摄入得越多越好 D.铵态氮肥与熟石灰混合使用可以明显提高肥效
试题详情
11.下列叙述正确的是 ( ) A.因为青少年的生长过程需要大量蛋白质,所以要多吃水果 B.油脂和糖类物质都能够为人体提供热量 C.合成纤维、合金、合成橡胶都是合成材料 D.焚烧塑料是解决“白色污染”的好办法 试题详情
12.下列观点中,你不赞同的是 ( ) A.不能用甲醛溶液浸泡水产品 B.肥皂水可以区别硬水和软水 C.生铁和钢都是铁的合金 D.淀粉没有甜味,因此不属于糖类 试题详情
13.重金属离子有毒性。实验室有甲、乙两种废液,均有一定毒性。甲废液经化验呈碱性,主要有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是 ( ) A.Cu2+和SO42- B.Cu2+和Cl- C.K+和SO42- D.Ag+和NO3- 试题详情
14.下列变化不能表明盐酸与氢氧化钠发生了反应的是 ( ) A.向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高 B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大 C.向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去 D.向氢氧化钠溶液中加入盐酸后,混合溶液的pH<7 试题详情
15.向结有水垢的热水瓶中加入稀盐酸,水垢溶解脱落;向所得溶液中加入过量 Na2CO3
溶液,又有白色沉淀出现,这种水垢可能有 ( ) A.BaSO4 B.CaCO3 C.K2CO3
D.AgNO3 试题详情
二、理解与应用(每空2分,20小题4分,共30分) 16.为了将汽油发动机尾气中的NO转化为N2,在某催化剂作用下用NH3与NO反应,其化学方程式为:aNH3 +
bNO=====5N2 + 6H2O;则a= , b= 。 试题详情
17.原子序数11―17元素的符号和原子结构示意图如下,请结合下图回答: 试题详情
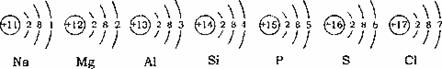 (1)结合上图用符号表示下列内容: ①原子序数为13的原子形成的离子符号____________, ②分子中含有两个原子物质的化学式_____________, 试题详情
③原子序数为12、17的元素组成化合物的化学式_______________。 (2)从11―17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:________________________________________。(任写一条) 试题详情
18.下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答: 试题详情
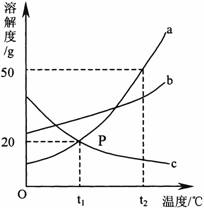 (1)P点的含义是
。 (2)t2℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗?
(填写“能”或“不能”)。 (3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是
(填写物质序号)。 (4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。 A.c>a=b B.a=b>c C.a>b>c
D.b>a>c 试题详情
19.科学研究发现影响化学反应速率的因素很多,请你归纳出其中三条影响化学反应速率的因素: 、
、
。 试题详情
20.通过你所知道的科学家对原子构成研究的历程,谈谈自己的感受和体会。 试题详情
三、实验与探究(每空2分,共16分) 21.小艾同学在妈妈买回的某食品包装内发现有一包白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”。小艾同学随手将小纸袋放在窗台上,过一段时间后发现纸袋内的白色颗粒粘在一起成为块状固体B。小艾同学请你和同学们一起对块状固体B进行探究。 (1)猜想一:块状固体B中除氧化钙外,还可能有
(写两种); (2)猜想二:块状固体B溶于水可能有
现象(填“放热”或“吸热”)。 (3)取块状固体B加入盛有一定量水的试管内,振荡、静置、过滤,得到少量白色固体C。就白色固体C同学们展开了热烈讨论,一起猜想。 小艾同学认为白色固体C可能是氢氧化钙,小聪同学认为白色固体C可能是碳酸钙;你认为白色固体C还可能是
(任写一种)。 试题详情
22.由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。 试题详情
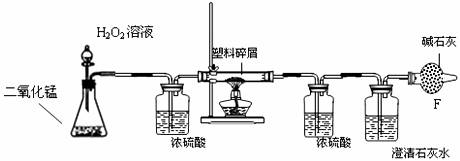
A
B
C
D E (1)仪器A中所发生的反应化学方程式为
。 (2)仪器B的作用是
。 (3)仪器E中的现象是
。 (4)若仪器C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重a g,则Wg该塑料试样中含氢元素的质量为
g(计算结果可为分数形式) (5)若装置中没有连接仪器B,将使该塑料试样中氢元素的质量测算结果 (填“偏小”、“偏大”、“无影响”中之一)。 试题详情
四、分析与计算(共9分) 23.“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的。现取20.0g某种黄铜投入100g某浓度的稀硫酸中,完全反应后剩余的溶液和残余固体总质量为119.8g。请计算: (1)产生氢气的质量为 g。 试题详情
(2)这种黄铜中铜的质量分数为多少?剩余溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%) 试题详情
|