揭阳二中2008~2009学年度第二学期阶段考试
化学科试题
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ca 40 Cu 64
Ag 108
第一部分选择题(共63分)
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1、焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( )
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaC1与Na2CO3灼烧时火焰颜色相同
试题详情
2、 新华社2007年3
月21日电,全国科学技术名词审定委员会21日公布:111号元素(符号为Rg)的中文名称为“ 钅仑 ”。下列说法正确的是( )
A.111号元素是第6周期、第ⅠA族的金属元素 B.111号元素属于过渡元素
C.111号元素为非金属元素
D.111号元素质量数为111
试题详情
3、化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
试题详情
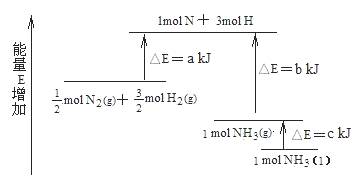
A.N2(g)+3H2(g)=2NH3(g) △H=2(b―a)kJ?mol-1
B. N2(g)+3H2(g)=2NH3(l)
△H=2(a―b―c)kJ?mol-1
C. N2(g)+H2(g)=NH3(l) △H=(b+c―a)kJ?mol-1
D. N2(g)+H2(g)=NH3(g) △H=(a+b)kJ?mol-1
试题详情
4、设NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
A.常温常压下,1mol氦气含有2NA个原子
试题详情
B.标准状况下,0.5NA个CCl4所占的体积约为11.2L
C.78g Na2O2 固体含有的阴离子数为NA
试题详情
D.用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属
试题详情
试题详情

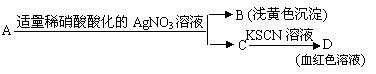
A、检验亚硫酸钠试样是否变质:
试题详情
试题详情
试题详情
试题详情
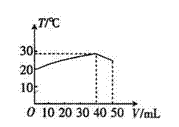 6、向盛有50mL
1.00mol?L-1HC1溶液的绝热容器中加入NaOH溶液,
6、向盛有50mL
1.00mol?L-1HC1溶液的绝热容器中加入NaOH溶液,
NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系
如图所示,下列叙述中不正确的是( )
A.该实验表明化学能可以转化为热能
试题详情
B.NaOH溶液的浓度大于1.00mol?L-1
C.V=50mL时,混合液的pH>7
D.该实验表明有水生成的反应都是放热反应
试题详情
7.已知25℃时,AgI饱和溶液中c
(Ag+)为1.22×10―8 mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10―5
mol/L。若在5 mL含有KCl和KI各为0.01
mol/L的溶液中,加入8 mL0.01 mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) D.c(K+)>c(NO3―)>c(Ag+)=
c(Cl-) + c(I-)
试题详情
8、现有常温下的四份溶液:①0.01mol?L-1CH3COOH;②0.01mol?L-1HC1;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是( )
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②=③
C.将四份溶液稀释相同倍数后,溶液的pH:③>④;②>①
D.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
试题详情
9.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是( )
①有固体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(H+)一定增大
A.① B.①③ C.①②④ D.①⑤
试题详情
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
10、X+、Y+、M2+、N2-均为含若干电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+>X+、Y+>M2+、M2+>X+。下列比较中正确的是( )
A.原子半径:N可能比Y大,也可能比Y小
B.原子序数:N>M>X>Y
C. M2+、N2-核外电子数:可能相等,也可能不等
D.碱性:M(OH)2 >YOH
试题详情
11、铜的冶炼大致可分为:①.富集,将硫化物矿进行浮选;
②.焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2
FeO(炉渣);
③.制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2
==2Cu2O+2SO2 ;2Cu2O+ Cu2S==6 Cu+SO2↑;
④.电解精炼铜。
下列说法正确的是( )
A.上述灼烧过程的尾气均可直接排空
B.上述过程中,由6mol
CuFeS2制取6molCu时共消耗12 molO2
C.在反应2Cu2O+
Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
D.电解精炼铜时,粗铜应与外接电源的正极相连接
试题详情
12、下列离子方程式书写正确的是( )
A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
试题详情
B.用石墨作电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.向Ca(ClO)2溶液中通入适量SO2 : Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.向氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
试题详情
13、室温下,某溶液中由水电离出的H+和OH-物质的量浓度乘积为1×10-28,该溶液中一定不能大量共存的是( )
A.Cl-、AlO2-、K+、Na+ B.Fe2+、NO3-、Ba2+、Cl-
C.Fe3+、SO42-、MnO4-、Na+ D.Na+、K+、CO32-、SO42-
试题详情
试题详情
A.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的关系: c(Cl-)>c(NH4+)>c(OH-)>c(H+)
试题详情
C.将0.1mol/L 醋酸溶液加大量水稀释后,溶液的pH增大
D.Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
试题详情
试题详情
A.配制100 mL 0.1
mol?L-1的NaCl溶液时,先量取10 mL 1 mol?L-1的NaCl溶液倒入容量瓶中,再加水稀释至刻度线
B.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
C.制备乙酸乙酯时,将乙醇和乙酸依次加入加入到浓硫酸中
D.乙醇与金属钠的反应,在盛有少量乙醇溶液的试管中,加入一小块新切的、用滤纸擦干表面煤油的金属钠
试题详情
16、下列叙述不正确的是( )
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料 B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性 D.利于环保、节能的太阳能电池可用硅材料制作
试题详情
17、在一定条件下密闭容器中的反应:2A(g)+B(g) 2C(g),△H<0到达平衡后,改变一个条件x,下列量y的变化一定符合图中曲线的是( )
2C(g),△H<0到达平衡后,改变一个条件x,下列量y的变化一定符合图中曲线的是( )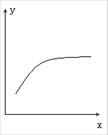
x
y
A
再加入A
B的转化率
B
再加入C
A的体积分数
C
缩小体积
A的转化率
D
升高温度
混合气体的平均摩尔质量
试题详情
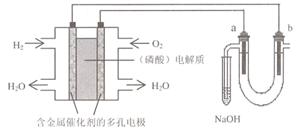 18、用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是( )
18、用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是( )
A.电池工作时,正极反应式为:
O2 +2 H2O + 4e―=
4OH?
B.电解时,a 电极周围首先放电的是Br-
而不是Cl-,说明当其它条件相同时前者的
还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
试题详情
D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
第二部分非选择题(共87分)
试题详情
三、(本题包括2小题,共27分)
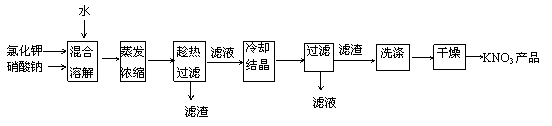 19(11分)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
19(11分)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
试题详情
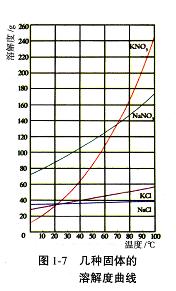
硝酸钾等四种物质的溶解度随温度变化如右图所示。回答下列问题: (1)为了加速固体溶解,可采取的措施是
。 (2)实验室进行蒸发浓缩操作时,将蒸发皿置于铁圈上,用酒精 灯加热。取用蒸发皿应使用
(填仪器的名称), 为了防止液滴飞溅,进行的操作是
。 (3)“趁热过滤”操作中,滤渣的主要成分是(填化学式) 。 (4)“趁热过滤”后,有时先往滤液中加入少量水,加热至沸,然 后再“冷却结晶”,目的是
。 (5)制得的KNO3产品中常含NaCl,进一步提纯的方法是 。 20(16分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
试题详情
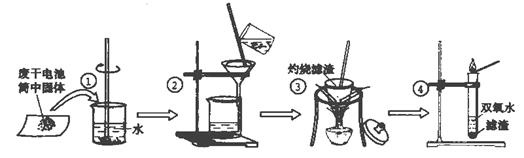
(1) 操作②中过滤时玻璃棒的作用: ; (2) 操作④加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式:
; (3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为:
。 (4) 已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程: (一)[猜想I]:主要成分为氯化铵; [验证(操作)过程]:取少量滤液加入NaOH固体,并加热; [实验现象]:闻到有轻微的氨味; [判断猜想]:
(“填猜想I成立”或“填猜想I不成立”); (二)[猜想II]:主要成分为氯化锌; [验证(操作)过程]:
; [实验现象]: ; [判断猜想]:猜想Ⅱ成立; 由上述实验得出的结论是:滤液中的主次成分:
。 t℃ 700 800 850 1000 1200 K 试题详情
四、(本题包括3小题,共40分)
试题详情
试题详情
试题详情
试题详情
0.6 21(13分)在一固定容积的密闭容器中进行 试题详情
着如下反应:CO2(g) + H2(g) CO(g) +H2O(g)
,其平衡常数K和温度t的关系如表: CO(g) +H2O(g)
,其平衡常数K和温度t的关系如表: (1) K的表达式为: ; (2) 该反应的正反应为 反应(“吸热”或“放热”); (3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变 C.v(H2)正 = v(H2O)逆 D.c(CO2) =
c(CO) 试题详情
(4) 在850℃时,可逆反应:CO2(g) + H2(g)  CO(g) + H2O(g),在该容器内各物质的浓度变化如下: CO(g) + H2O(g),在该容器内各物质的浓度变化如下: 时间/min CO2
(mol/L) H2
(mol/L) CO
(mol/L) H2
O ( mol/L) 0 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
0.062 3 c1 c2 c3 c3 4 c1 c2 c3 c3 计算:3min―4min达到平衡时CO的平衡浓度c3和CO2(g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。 22(12分)以下是25℃时几种难溶电解质的溶解度: 难溶电解质 Mg(OH)2 Cu(OH)2 Fe(OH)2 Fe(OH)3 溶解度/g 9×10-4 试题详情
试题详情
试题详情
3.0×10-9 在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如: ①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可; ②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可; ③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。 请回答下列问题: (1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为_______________(填化学式)而除去。 (2)①中加入的试剂应该选择_________为宜,其原因_____________________________。 (3)②中除去Fe3+所发生的总反应的离子方程式__________________________________。 (4)下列与方案③相关的叙述中,正确的是__________________(填字母)。 A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染 B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤 C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜 D.Cu2+可以大量存在于pH=4的溶液中 E.在pH>4的溶液中Fe3+一定不能大量存在 23(15分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格,表中内容为该族元素的部分性质。 性质\元素 8O 16S 34Se 52Te 单质熔点(℃) 试题详情
试题详情
444.6 685 1390 主要化合价 -2 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 单质与H2反应情况 点燃易化合 加热化合 加热难化合 不能直接化合 请根据表回答下列问题: (1)硒的熔点范围可能是
;(2)碲的化合价可能有
; (3)硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是 (填化学式); (4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为
; 试题详情
(5)已知在常温下,生成17g
H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式: 试题详情
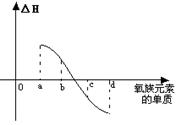
(6)右图所示为氧族元素单质与H2反应过程中的能量 变化示意图,其中a、b、c、d分别表示氧族中某一元素 的单质,△H为相同物质的量的单质与H2反应的反应热。 则:b代表
,d代表
(均写单质名称)。 五、(本题包括1小题,共10分) 试题详情
24. (10分)生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。 (1)乙醇是无色有特殊香味的液体,密度比水_________。 (2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________ (不用写反应条件),原子利用率是_________ 。 (3)下列属于乙醇的同系物的是_____,属于乙醇的同分异构体的是_____。(选填编号) 试题详情
(4)乙醇能够发生氧化反应: ① 46 g乙醇完全燃烧消耗__________mol氧气。 ②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_____________。 ③下列说法正确的是__________。(选填字母) A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应 B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车 C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯 六、(本题包括2小题,每小题10分。考生只能选做一题。25题为“有机化学基础”内容试题,26小题为“物质结构”内容试题)
|
试题详情
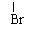 (?)CH3CHCH3 ――――――――→CH3CH==CH2 +
(CH3)2CHOC2H5+HBr (?)CH3CHCH3 ――――――――→CH3CH==CH2 +
(CH3)2CHOC2H5+HBr
|
试题详情
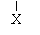 (?)CH3CH2CHCH3――――――→ CH3CH==CHCH3+ CH3CH2CH==CH2+HX (?)CH3CH2CHCH3――――――→ CH3CH==CHCH3+ CH3CH2CH==CH2+HX
试题详情
X为Cl
65%
35% X为Br
75%
25% X为I
80%
20% ⑴根据上面两个反应的条件及其数据,请写出你认为最具概括性的两条结论:①
。 ②
。 ⑵由丙烯经下列反应可制得化工原料H及F、G两种高分子化合物(它们都是常用的塑料),其合成线路如下: 试题详情
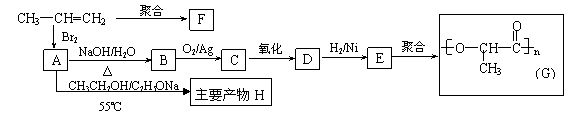
请完成下列填空: ①写出结构简式:聚合物F是
,产物H
; ②B转化为C的化学方程式为:
; ③在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简是
。 试题详情
26. (10分)(1)原子数相同、电子总数相同的分子,互称为等电子体,CO与N2互为等电子体。Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。Ni原子的价电子排布式为
。Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
(填晶体类型);Fe(CO)5是配合物,配体是__________
。 试题详情
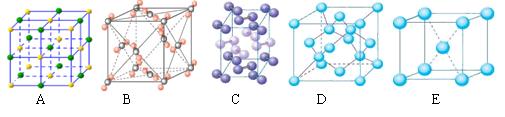
 (2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写) (2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
试题详情
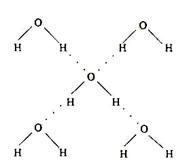
 (3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol; (3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。 试题详情
 揭阳第二中学2008―2009学年度第二学期第一次阶段考试 揭阳第二中学2008―2009学年度第二学期第一次阶段考试
化学科答题卷 题号 一 二 三 四 五 六 总分 得分 题号 1 2 3 4 5 6 7 8 9 答案 题号 10 11 12 13 14 15 16 17 18 答案 第Ⅰ卷(选择题,共63分) 第Ⅱ卷(非选择题,共87分) 19(11分) (1)
。 (2)
,
。 (3)
。 (4)
。 (5) 。 20(16分) (1) ; (2)
; (3) 。 (4) [判断猜想]:
; [验证(操作)过程]:
; [实验现象]:
; 滤液中的主次成分:
。 21(13分) (1) ; (2) ; (3) ; (4) [解题过程] 22(12分) (1)_______________。 (2)①
,
。 (3)②
。 (4)__________________。 23(15分) (1)
;(2)
; (3)
; (4)
,
; (5)
(6)b代表
,d代表
。 五、(本题包括1小题,共10分) 试题详情
四、(本题包括3小题,共40分) 24.(10分) (1)_________。 (2)
,_________ 。 (3)
, 。 (4)① __________。 ②
。 ③
。 六、(本题包括2小题,每小题10分。考生只能选做一题。25题为“有机化学基础”内容试题,26小题为“物质结构”内容试题) 试题详情
25.(10分) ⑴①
。 ②
。 ⑵ ①F
,H
; ②
; ③
。 试题详情
26. (10分) (1)
。
;__________
。 (2)
。 (3)_________; (4)
。 试题详情
一、二(63分) 题序 1 2 3 4 5 6 7 8 9 答案 D B B C B D A C D 题序 10 11 12 13 14 15 16 17 18 答案 C D AD B CD B A AC BD 三、(本题包括2小题,共27分) 19、(11分)(1)搅拌、加热(2分)(2)坩埚钳(1分),用玻璃棒不断搅拌滤液(1分)(3)NaCl(2分)  (4)稀释溶液,防止降温过程中NaCl析出,提高产品纯度(3分)(5)重结晶(2分)。 (4)稀释溶液,防止降温过程中NaCl析出,提高产品纯度(3分)(5)重结晶(2分)。
20(16分)(1)引流作用(1分) (2) 2H2O2 == 2H2O + O2↑(3分) (3) 炭(或碳、或C) (2分) (4)(一)[判断猜想]:猜想I不成立 (1分) (二)[验证(操作)过程]:取少量滤液逐滴滴入稀氨水 (3分) [实验现象]:先有白色沉淀、滴入过量稀氨水后白色沉淀溶解(3分); [判断猜想]:结论:主要为氯化锌,其中含少量的氯化铵(3分)。 [若说成氯化铵和氯化锌的混合物给1分;若说成只有氯化锌没有氯化铵0分] 四、(本题包括3小题,共40分) 21(13分)(1) ;(2分) ;(2)放热;(2分) ;(2分) ;(2)放热;(2分) (3)B、C; (3分,若只选一个对的得1分,全对得3分)
(4)设3min―4min达到平衡时CO、H2 O的平衡浓度为c3, 则CO2 、H2的平衡浓度分别为0.200-c3和0.300- c3 根据: K= (2分) (2分) c3=0.120
mol/L (2分,写0.12的不给分) ;
CO2 (g)的转化率= (2分) (2分) 22(12分)(1)Fe(OH)3(2分) (2)氨水 (2分) 不会引入新的杂质(1分) (3)2Fe3++3Mg(OH)2 == 3 Mg2+ +2Fe(OH)3 (3分) (4)A C D E (4分)(选对1个给1分,选错1个倒扣1分,但不出现负分。) 23(15分)(1)113~452℃(1分)(2)-2、+4、+6 (全对得2分,错漏1个扣1分,扣完为止)(3)H2Te>H2Se>H2S(2分)(4)还原性 (1分) 2H2Se + O2 == 2H2O
+ 2Se (2分) (5)H2S(g) = H2(g) +
S(s) △H =
+112.2KJ/mol (3分) (6) 硒 (2分) 氧气 (2分) 五、(本题包括1小题,共10分) 24.(10分)(1)小(1分)(2)CH2=CH2
+ H2O → CH3CH2OH
(1分)100%(1分) (3)D
E(共2分)(4)①3(2分)  ②
(1分) ②
(1分)
③BCD(2分,漏1个扣1分,漏2个和错选均为0分) 六、(本题包括2小题,每小题10分。考生只能选做一题。26题为“有机化学基础”内容试题,27小题为“物质结构”内容试题) 25 (10分)(1)[根据答到的要点或关键词给分] ①在此条件下,卤代烃的消去反应和取代反应同时进行(1分),有利于消去反应(1分)。 ②在此条件下,有利于生成对称烯烃(1分),且卤原子半径越大(1分)越有利于生成对称烯烃(1分)。 若回答只是数据翻译,如:消去(取代)产物比例较大(小),或消去反应谁的比例大、谁的比例小,说出一点给1分,说出几点都如此最多给2分。
⑵①
(1分) CH3C≡CH (1分)
 ②
(2分) ③
(1分) ②
(2分) ③
(1分)
26.(10分) (1) 3d84s2
(2分) ,分子晶体(1分), CO(1分)。 (2) B C (2分) (3)20 (2分) (4)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
| | | | | |

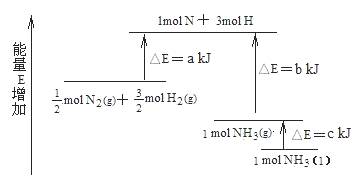



 6、向盛有50mL
1.00mol?L-1HC1溶液的绝热容器中加入NaOH溶液,
6、向盛有50mL
1.00mol?L-1HC1溶液的绝热容器中加入NaOH溶液, Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-

 18、用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是( )
18、用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是( ) 19(11分)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
19(11分)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下: