
2009届江苏省启东中学高三12月月考试卷化学试题
可能用到的相对原子质量:H
第一卷(选择题 共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
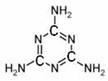 1、化学工作者和社会各界都一直关注食品安全问题,目前国内的“三鹿毒奶粉”事件是不法奶商向原奶中加入了三聚氰胺,其结构简式如右下图。下列关于三聚氰胺的说法不正确的是
1、化学工作者和社会各界都一直关注食品安全问题,目前国内的“三鹿毒奶粉”事件是不法奶商向原奶中加入了三聚氰胺,其结构简式如右下图。下列关于三聚氰胺的说法不正确的是
A.含有不饱和碳原子,在一定条件下能发生加成反应
B.不法分子因为三聚氰胺含氮量较高才用其造假
C.分子中所有原子都在同一平面上
D.在一定条件下能发生氧化反应
2、广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱性物质
3、NA代表阿伏加德罗常数。下列说法中,不正确的是
A.标准状况下,NO和 O2各
B.
C.1 mol C30H62 分子中含有共价键的数目为 91 NA
D.
4、下列颜色不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色
B.久置的KI溶液呈黄色
C.新制氯水久置后变为无色
D.普通玻璃导管口点燃纯净氢气时,火焰呈黄色
 5、一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH + 3O2 +4OH-
5、一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH + 3O2 +4OH-
 2CO32- +6H2O,则有关说法正确的是
2CO32- +6H2O,则有关说法正确的是
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH +8 OH- - 6e- = CO32- + 6H2O
C.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
6、A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-具有相同的电子层结构,下列叙述一定不正确的是
A.离子半径A2-> C->B2+ B.它们的原子半径C>B>A
C.它们的原子序数A>B>C D.原子最外层上的电子数C>A>B
7、下列有关叙述:① 非金属单质M能从N的化合物中置换出非金属单质N;② M原子比N原子容易得到电子;③单质M跟H2反应比N跟H2反应容易得多;④气态氢化物水溶液的酸性HmM>HnN;⑤氧化物水化物的酸性HmMOx>HnNOy;⑥熔点M>N。能说明非金属元素M比N的非金属性强的是
A.②⑤ B.①②③? C.①②③⑤ D.全部
8、下列各组离子,在指定的环境中一定能大量共存的是
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3―、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2―、NO3―、CO32―
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42―、Cl―、NO3―
D.由水电离出的c(H+)=1×10-12mol?L-1的溶液中:K+、Cl-、NO3―、Na+
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9、高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是
A. Na2O2在反应中既作氧化剂,又作还原剂
B. 制取高铁酸钠时,每生成lmolNa2FeO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D. K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
10、下列离子方程式不正确的是
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合
4AlO2-+ 7H+ + H2O = 3Al(OH)3↓+ Al3+
C.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色
5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4- + 2H2O
D.甲醛溶液中加入足量的银氨溶液并加热
HCHO+2[Ag
(NH3)2]++2OH-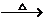 HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
11.“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
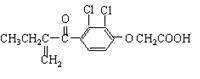

①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂均属于芳香烃化合物
D.两种分子中的所有碳原子均不可能共平面
12、已知某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。
A.c(H+)•c(OH-) >1×10-14
B.c(H+) +
C. c(Na+)+ c(H+)=
c(H2XO4-)+ c(OH-)+
D.c(H+) + c(H3XO4)=
c(HXO42-)+
13.将某些化学知识用数轴表示直观形象、简明易记。下列用数轴表示正确的是
A.平衡常数与转化率关系:
B.分散系的分类: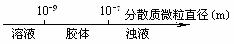

 C.AlCl3和NaOH反应后铝元素的存在形式:
C.AlCl3和NaOH反应后铝元素的存在形式: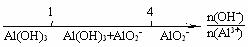
D.Na在O2中的燃烧产物: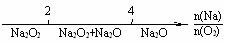
14、a
g下列物质在氧气中充分燃烧后的气体(1.01×105
Pa,
A.HCHO B.CH3COOCH2CH
第二卷(非选择题 共72分)
三、(本题包括1小题,共10分)
15、(10分) 碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2?3Cu(OH)2?XH2O(X=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:① 取a g的晶体研成粉末。② 晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。③ 另取a g的晶体,溶于足量某溶液中充分溶解得到溶液。④ 向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有 ____ (填序号)。
(2)步骤②中晶体应放在______ __(填仪器名称)中灼烧,灼烧后得到的固体应为___________(填化学式)。
(3)步骤③所用的溶液可能是 ;
(4)步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量;
(5)若组成符合通式,则可以计算X的物理量组合是 ____ (填序号)。
A.a、b B.a、c C.b、c D.a、b、c缺一不可
四、(本题包括2小题,共18分)
16.(8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
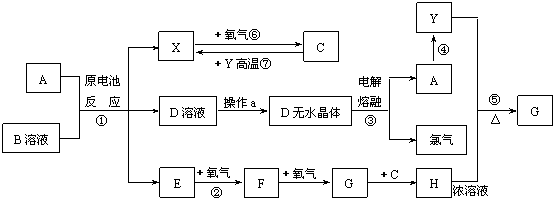
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
17.(10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
阳离子
H+、Na+、A13+、Ag+、Ba2+
阴离子
OH―、C1―、CO32―、NO3―、SO4―
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);
△H=-a KJ?mol-1。请写出B与C的稀溶液反应的热化学方程式
。
(4)在100mL0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到沉淀物质的量为 。
五、(本题包括1小题,共10分)
18.(10分)红矾钠(重铬酸钠:Na2Cr2O7?2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1) 实验室中红矾钠可用铬铁矿(主要成分:FeO?Cr2O3)利用以下过程来制取。
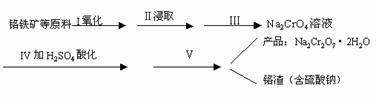
①步骤I中反应的化学方程式为:
4FeO?Cr2O3(s)+8Na2CO3(s)+7O2
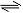 8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
该反应的化学平衡常数的表达式为 。
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2 min时,曲线发生变化的原因是 (用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 ____ (填编号)
a.升高温度 b.加了催化剂 c.将原料粉碎 d.缩小容器体积
(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
②步骤Ⅳ中发生反应的离子方程式为: 。
六、(本题包括1小题,共12分)
19.(12分)将羧酸的碱金属盐溶液用惰性电极电解可得到烃类化合物,例如:
2CH3COOK+2H2O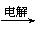
 CH3CH3↑+2CO2↑+H2↑+2KOH
CH3CH3↑+2CO2↑+H2↑+2KOH
现有下列衍变关系(A、B、C、D、E、F、G均为有机物):
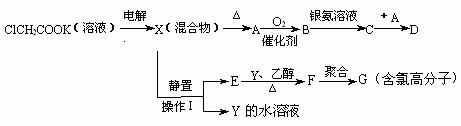
回答下列问题:
(1)写出电解ClCH2COOK溶液时的阳极的电极反应式_____________________。
(2)操作Ⅰ的名称是_____________,G的结构简式是_________________。
(3)写出B与银氨溶液按物质的量1:4反应生成C的化学方程式________________。
(4)A和C在不同条件下反应,会生成不同的D。
①若D的相对分子质量是B的2倍,则D的结构简式是_____________________;
②若D是高分子化合物,则D的结构简式是____________________。
七、(本题包括1小题,共10分)
20、(10分)惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
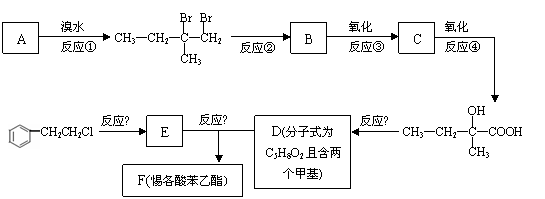

试回答下列问题:
(1)A的结构简式为 ;F的结构简式为 。
(2)反应②中另加的试剂是 ;反应⑤的一般条件是 。
(3)反应③的化学方程式为 。
(4)上述合成路线中属于取代反应的是 (填编号)。
八、(本题包括1小题,共12分)
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
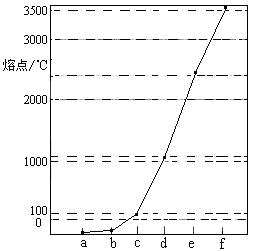
(1)请写出上图中d单质对应元素原子的电子排布式 。
 (2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含 个
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含 个 键和 个
键和 个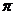 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为 ,其中X与Ag+之间以 键结合。
(4)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因 。
1.C 2.B 3.A 4.D 5.B 6.B 7.B 8.D 9.B 10.AD 11.B 12.AC 13.B 14.BD
|