
启东市汇龙中学2008―2009学年度高三年级第三次月考
化 学 试 卷
(考试时间:100分钟 总分120分)
可能用到的相对原子质量:H-1 C-12 O-16 N―14 Na-23 Mg-24 Al―27 P-31 Si-28 K-39 Ca-40 Fe-56 Pb-207
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1、化学与生活、社会密切相关。下列说法不正确的是
A、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B、凡含有食品添加剂的食物对人体健康均有害,不可食用
C、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D、提倡人们购物时不用塑料袋,是为了防止白色污染
2、2008年度诺贝尔化学奖授予在绿色荧光蛋白(GFP)研究和应用方面做出的突出贡献的日本科学家下村修、美国科学家马丁?沙尔菲,以及美国华裔科学家钱永健。GFP 是一个分子量较小的蛋白,最初是由下村修在水母中发现的,它易与其他一些目的基因形成融合蛋白且不影响自身的目的基因产物的空间构象和功能,从而作为标记蛋白。以下关于荧光蛋白的说法正确的是
A、GFP不属于天然蛋白质 B、该种蛋白质水解不能得到氨基酸
C、遇甲醛可使其变性 D、GFP不属于高分子化合物
3、下列说法不正确的是
A、根据沸点差异可以判断两种液体混合物是否可用蒸馏方法进行分离
B、根据固体溶解度曲线可以判断物质结晶的方法
C、根据熵变可以判断所有化学反应能否自发进行
D、根据化学平衡常数可以判断化学反应进行的限度
4、下列表示物质结构的化学用语或模型正确的是
A、用于测定文物年代的碳原子的核素符号:12
B、乙烯的结构简式 :C2H4
C、HF的电子式: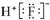
 |
D、乙酸分子的比例模型:
 5、阿佛加德罗常数约为6.02×1023mol―1,下列说法中一定正确的是
5、阿佛加德罗常数约为6.02×1023mol―1,下列说法中一定正确的是
A、60gSiO2晶体中含有2×6.02×1023个Si―O键
B、18D2O(重水)完全电解,转移2×6.02×1023个电子
C、720gC60晶体(如右图)中含有6.02×1023个晶胞结构单元
D、
6、下列情况下,可以大量共存的离子组是
A、使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
B、由水电离的c(H+) = 1×10-14 mol?L-1的溶液中:Ba2+、K+、Cl-、HCO3-
C、在c(H+)/ c(OH-)=1012的溶液中:NH4+ 、Al3+、Ca2+、Cl-
D、与铝反应放出大量氢气的溶液中:NH4+、SO42-、CO32-、Na+
7、下列装置或操作能达到实验目的的是
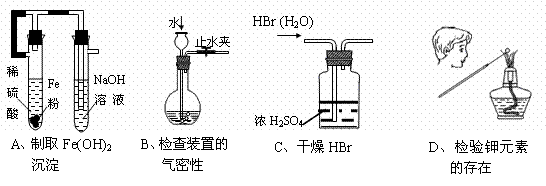 |
8、一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在
物质
AgCl
AgI
Ag2S
颜色
白
黄
黑
KSP(
1.8×10-10
1.5×10-16
1.8×10-50
下列叙述不正确的是
A、溶度积小的沉淀可以转化为溶度积更小的沉淀
B、若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C、
D、
二、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。)
9、下列离子方程式书写正确的是
A、向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH- = CaCO3↓+CO32-+2H2O
B、向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I- = 2I2+2H2O
C、次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O = 2HClO+SO32-
D、硫化钠的水解反应:S2-+H3O+ HS-+H2O
HS-+H2O
10、用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是
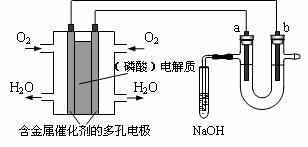
A、电池工作时,正极反应式为O2 + 2H2O + 4e- == 4 OH-
B、电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D、忽略能量消耗,当电池中消耗
11、钢铁“发蓝”的一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3 Na2Fe2O4+ NH3↑+7NaOH
③Na2FeO2+ Na2Fe2O4+2H2O=Fe3O4+4NaOH 下列说法不正确的是
A、该生产过程会产生污染
B、反应②中的氧化剂是NaNO2
C、整个反应过程中每有16.8gFe参加反应转移0.8mol电子
D、反应①②③均属于氧化还原反应
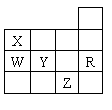 12、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
12、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A、X的简单氢化物的空间构型为三角锥形
B、Y、Z的阴离子电子层结构都与R原子的相同
C、Y元素的非金属性比W元素的非金属性强
D、W的氢化物沸点比X的氢化物的沸点高
13、草酸是二元中强酸,测得0.01 mol?L-1的草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol?L-1 NaHC2O4溶液中滴加0.01 mol?L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是
A、V(NaOH) = 0时, c(Na+)> c(H+)> c(HC2O4- )> c(C2O42 -)> c(OH-)
B、V(NaOH) = 5时, c(Na+)=c(C2O42 -)+c(HC2O4- ) +c(H
C、V(NaOH) = 10 mL时, c(Na+) = c(HC2O4- )+
D、V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
14、2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是:
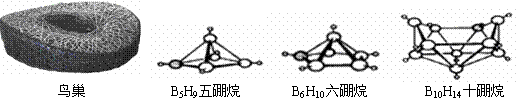 |
A、这类巢式硼烷的通式是BnHn+4 B、1mol B5H9完全燃烧转移24mol电子
C、8个硼原子的巢式硼烷化学式应为B8H10 D、硼烷与水反应是非氧化还原反应
第Ⅱ卷(非选择题 共72分)
三、(本题包括1小题,共10分)
15、莫尔盐的化学式为(NH4)2SO4?FeSO4?6H2O,将(NH4)2SO4、FeSO4等物质的量混合可制得莫尔盐。下表列出几种盐在一定温度下的溶解度(g/100gH2O):
温度/℃
FeSO4?7H2O
(NH4)2SO4
(NH4)2SO4?FeSO4?6H2O
10
20.0
73.0
17.2
20
26.5
75.4
21.6
30
32.9
78.0
28.1
实验室制取少量莫尔盐的流程如下:
试回答下列问题:
⑴步骤1的主要作用是 ;
⑵步骤2中水浴加热后需要趁热过滤,趁热过滤的目的是 ;
⑶步骤3中加热浓缩至出现结晶薄膜时为止,原因是 。
⑷步骤3中析出的晶体不含(NH4)2SO4、FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
四、(本题包括2小题,共18分)
16、(8分)钨(74W)是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要是钨酸盐(其中钨为+6价)的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO4。黑钨矿传统冶炼第一阶段是碱熔法:
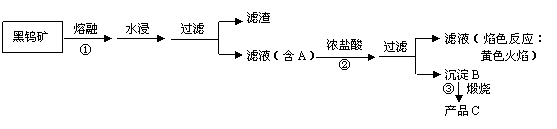 (其中A、B、C都是钨的化合物)
(其中A、B、C都是钨的化合物)
⑴写出上述流程中步骤②③中发生反应的化学方程式:
②
③
⑵钨冶炼工艺的第二阶段则是用碳、氢等还原剂把产品C还原为金属钨。对钨的纯度要求不高时,可用碳作还原剂,写出碳还原产品C制取金属钨的化学方程式
。
⑶为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气的理由是
。
 17、(10分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为
17、(10分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为
 ⑴图中共有两条曲线X和Y,其中曲线 表示NO2浓度
⑴图中共有两条曲线X和Y,其中曲线 表示NO2浓度
随时间的变化;a、b、c、d四个点中,表示化学反应处
于平衡状态的点是 。
⑵①前10min内用NO2表示的化学反应速率
v(NO2)= mol/(L?min)
 ②15min时,反应2NO2(g)
N2O4(g)在b点的浓度
②15min时,反应2NO2(g)
N2O4(g)在b点的浓度
平衡常数K(b)=
 ③35min时,反应2NO2(g)
N2O4(g)在d点的浓度平衡常数K(d) K(b)
③35min时,反应2NO2(g)
N2O4(g)在d点的浓度平衡常数K(d) K(b)
(填“>”、“=”或“<”)
⑶①若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是 。
A、加入催化剂 B、缩小容器体积 C、升高温度 D、加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小玻璃容器的体积至
五、(本题包括1小题,共12分)
18、2005年的诺贝尔化学奖颁给了在烯烃复分解反应研究方面做出突出贡献的3位化学家。烯烃复分解反应实现了在一定条件下烯烃中碳碳双键两边基团的换位。
如:2CH2=CHCH2CH3 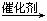 CH2=CH2+CH3CH2CH=CHCH2CH3。
CH2=CH2+CH3CH2CH=CHCH2CH3。
又已知:两个醛分子在一定条件下可以发生加成反应:
 |
 现仅以丙烯为有机原料,经过下列反应可以分别合成重要的化工原料F和K,以F和K为原料可合成一种链状高分子化合物M,其化学组成为(C12H20O4)n。
现仅以丙烯为有机原料,经过下列反应可以分别合成重要的化工原料F和K,以F和K为原料可合成一种链状高分子化合物M,其化学组成为(C12H20O4)n。
⑴反应①的反应类型是:_________________。
⑵反应⑥、⑦中有一反应是与HCl加成,该反应是_____(填反应编号),设计这一步反应的目的是_____________________________________________________。
⑶物质M的结构简式为:______________________________________。
⑷写出下列反应的化学方程式:
反应⑧:_____________________________________________________________;
反应⑩:_____________________________________________________________。
六、(本题包括1小题,共10分)
19、请应用所学的化学知识,来解答以下有关的环境问题:
⑴大气中氯氟烃的减少带来的积极效果是 ;
 ⑵空气中硫氧化物和氮氧化物是形成酸雨的主要物质。若用NOx表示氮氧化物,请写出空气中氮氧化物形成酸雨的化学方程式 ;
⑵空气中硫氧化物和氮氧化物是形成酸雨的主要物质。若用NOx表示氮氧化物,请写出空气中氮氧化物形成酸雨的化学方程式 ;
⑶在发动机和三元催化转化器间的尾气流中安装一个称为
λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完
全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,
入口处的空气量增大,此时排出尾气中的主要污染物是
。在转化器的前半部,一氧化碳和氮氧化物(NOx)
通过催化剂发生反应转化为无污染的气体,其反应的化学方
程式为 。为了降低汽车尾气对
大气的污染,有关部门拟用甲醇替代作为公交车的燃料。
已知:甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式
。
⑷2007年春夏之交无锡太湖蓝藻事件再次给水资源保护敲响警钟。检测显示,蓝藻爆发时太湖全湖N、P平均含量分别高达4.0和0.13 mg/L。环境专家建议用金属镁将水体中的NO3-还原为N2而消除污染,Mg则转变为Mg(OH)2沉降湖底。要使太湖水中N的平均含量下降至0.20 mg/L,则每立方米水体中应投入的镁粉应不少于 g。
七、(本题包括1小题,共10分)
20、已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
⑴试写出Pb2O3与浓盐酸反应的化学方程式 。
⑵通过计算确定y与a、x的函数关系式。
⑶若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为
;其物质的量之比为 。
八、(本题包括1小题,共12分)
21、下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
A【物质结构与性质】
A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

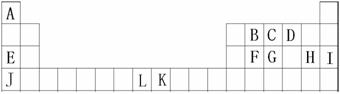
⑴元素K的核外电子简化排布式 ;
⑵B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示);
⑶2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净L(可用于合成氨
反应的催化剂)的表面上存在C原子,右上图为C原子在L的晶面上的单层附着局部示意 图(图中小黑色球代表C原子,灰色球代表L原子)。则在图示状况下,L颗粒表面上L/C
原子数之比为 。
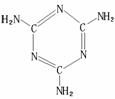 ⑷A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如右图),
⑷A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如右图),
由于其含氮量相当高被不法奶农添加到牛奶中来“提高”蛋白质的
含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺
中二种环境的N原子的杂化形式分别是 ;三聚氰胺
难溶于冷水但易溶于热水,以尿素为原料,以氨气为载体,硅
胶为催化剂,在380-400℃温度下沸腾反应生成三聚氰胺:6CO(NH2)2→
C3N6H6+6NH3+3CO2制得的三聚氰胺粗产品中既含有不溶于水的杂质,又含有易溶于水的杂质,简述从粗产品中提纯三聚氰胺的方法:
;
⑸有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列
(填这些物质的序号)
B【实验化学】
苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。
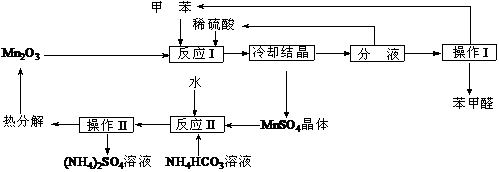
试回答下列问题:
⑴已知甲苯和苯甲醛的沸点分别为
⑵反应I所发生的主要化学反应的方程式可表示为 。
⑶实验中反应II应加入稍过量的NH4HCO3溶液,其目的是 。
⑷实验中发现,甲苯转化为苯甲醛的转化率不可能达到100%,其可能的原因是 。
⑸该工艺流程最大的优点是尽可能的实现原料的循环使用和副产物的综合利用,该工艺体现的基本思想是 。
启东市汇龙中学2008―2009学年度高三年级第二次月考
一、二、选择题
题号
1
2
3
4
5
6
7
8
答案
B
C
C
D
D
C
B
C
题号
9
10
11
12
13
14
答案
B
BD
D
AC
D
AB
三、(本题包括1小题,共10分)
15、⑴ 除去铁屑表面的油污;⑵减少FeSO4的损失;⑶防止失去结晶水以及Fe2+、NH4+的水解;⑷ 在相同温度下,(NH4)2SO4?FeSO4?6H2O的溶解度比(NH4)2SO4、FeSO4小
 g(每空2分)
g(每空2分)
四、(本题包括2小题,共18分)
16、⑴②Na2WO4+2HCl==H2WO4+2NaCl ;③::H2WO4==WO3+H2O (每空2分)
⑵WO3+
⑶如果用碳作还原剂,混杂在金属中的碳不易除去,而且碳在高温下和金属钨也能生成碳化钨,不容易获得纯净的金属钨。H2作还原剂,过量的H2会从体系中自动逸出。
17、⑴X (1分); b和d(2分);⑵①0.04(1分); ②Kb=10/
五、(本题包括1小题,共12分)
18、⑴加成反应 ⑵⑥ 保护B(或G)分子中的C=C不被氧化
 |
⑶
⑷ HOOCCH2CHClCOOH+3NaOH NaOOCCH=CHCOONa+NaCl+3H2O
NaOOCCH=CHCOONa+NaCl+3H2O
2CH3CH2CH2CH2OH+HOOCCH=CHCOOH
CH3(CH2)3OOCCH=CHCOO(CH2)3CH3+2H2O (每空2分,共12分)
六、(本题包括1小题,共10分)
 ⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑴减缓臭氧空洞的增大(1分);⑵4NOx+(5-2x)O2+2H2O=4HNO3(2分);
⑶NOx(或氮氧化物)(1分) 2NOx+2xCO N2+2xCO2(2分)
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1);△H=-1452kJ/mol(2分)⑷1.62×10-2(2分)
七、(本题包括1小题,共10分)
⑴Pb2O3+6HCl(浓)=2PbCl2+Cl2↑+3H2O(2分)
⑵根据题意:分解所得混合物中n(Pb2+)= ax mol、n(Pb4+)= a (1-x) mol
根据电子守恒:n(O2)= ax/2 mol、n(Cl2)=a (1-x) mol (2分)
y=n(O2)+n(Cl2)=ax/2 mol+a (1-x) mol=a (1-x/2) mol(2分)
⑶ Pb3O4、PbO 3:4(4分)
提示:当分解产物为Pb2O3时,x=1/2;
当分解产物为Pb3O4时,x=2/3;
当分解产物为PbO时,x=1。
根据题意有:n(O2)/ n(Cl2)=5:3,即x=10/13
所以此时剩余固体包括Pb3O4、PbO两种物质,其物质的量之比为3:4。
注:答题中出现的其它合理答案均给分。
八、(本题包括1小题,共12分)
A【物质结构与性质】
⑴[Ar]3d74s2;⑵N>O>C;⑶2:1;⑷sp2、sp3;将粗产品加入到热水中,趁热过滤,带滤液冷却有大量晶体析出时再过滤;⑸⑤③④①②(每空2分)
B【实验化学】
⑴蒸馏、过滤
⑵ 
⑶使碳酸锰沉淀完全; ⑷反应过程中有副反应产生,或苯甲醛可能被氧化成苯甲酸,或该反应有一定的限度。⑸绿色化学(每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com