
题目列表(包括答案和解析)
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A-) |
| 实验编号 | HA溶液体积(mL) | NaOH溶液体积(mL) | 混合溶液的pH |
| 甲 | 20.00 | 20.00 | a |
| 乙 | 20.00 | V | 7 |
| 丙 | 20.00 | 10.00 | <7 |
(1)甲同学在实验中需要0.4mol/L的NaOH溶液240mL,现实验室中只有容积分别为100mL、250mL、500mL三种容量瓶,他应该选用___________________容量瓶.
(2)经计算并正确地称量了NaOH固体后,其后续操作如下:
①将NaOH固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌溶解.
②待溶液冷却至室温后,转移至未经干燥的容量瓶中.
③向容量瓶中加蒸馏水直到离刻度线1~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
④盖好瓶塞,反复上下颠倒,摇匀.
上述实验操作过程中有一处明显的错误,请用语言叙述并指出对所配溶液浓度的影响:________________________________________________.
(3)乙同学在实验中需用浓度为1mol/L的NaOH溶液50mL,现实验室中有浓度为5mol/L的NaOH溶液和蒸馏水,实验仪器只有量筒、烧杯和玻璃棒,无容量瓶.考虑到实验室的实际情况,请你简要地描述他应该如何配制.
(1)甲同学在实验中需要0.4mol/L的NaOH溶液240mL,现实验室中只有容积分别为100mL、250mL、500mL三种容量瓶,他应该选用___________________容量瓶.
(2)经计算并正确地称量了NaOH固体后,其后续操作如下:
①将NaOH固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌溶解.
②待溶液冷却至室温后,转移至未经干燥的容量瓶中.
③向容量瓶中加蒸馏水直到离刻度线1~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
④盖好瓶塞,反复上下颠倒,摇匀.
上述实验操作过程中有一处明显的错误,请用语言叙述并指出对所配溶液浓度的影响:________________________________________________.
(3)乙同学在实验中需用浓度为1mol/L的NaOH溶液50mL,现实验室中有浓度为5mol/L的NaOH溶液和蒸馏水,实验仪器只有量筒、烧杯和玻璃棒,无容量瓶.考虑到实验室的实际情况,请你简要地描述他应该如何配制.
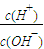 =1010,请回答下列问题:
=1010,请回答下列问题: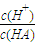 B.
B. C.c(H+)?c(OH-) D.c(OH-)
C.c(H+)?c(OH-) D.c(OH-)| 实验编号 | HA溶液体积(mL) | NaOH溶液体积(mL) | 混合溶液的pH |
| 甲 | 20.00 | 20.00 | a |
| 乙 | 20.00 | V | 7 |
| 丙 | 20.00 | 10.00 | <7 |
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2后,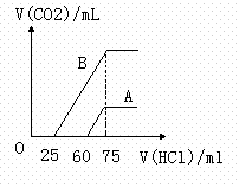 再分别稀释到100 mL,在稀释后的溶液中分别滴加0.1mol/L的盐酸,产生的CO2体积(标准状况)与所加盐酸的体积关系如图所示,下列说法正确的是
再分别稀释到100 mL,在稀释后的溶液中分别滴加0.1mol/L的盐酸,产生的CO2体积(标准状况)与所加盐酸的体积关系如图所示,下列说法正确的是
A.原NaOH溶液的物质的量浓度0.15mol/L
![]()
B.A曲线表明原溶液通入CO2后,所得溶质为NaOH和Na2CO3,此时用酚酞作指示剂,溶液颜色变化时消耗盐酸的体积为75mL
C.B曲线表明原溶液通入CO2后,所得溶质为Na2CO3和NaHCO3且物质的量之比为1:1
![]() D.B曲线表明原溶液通入CO2后,所得溶质与盐酸反应产生的最大体积为33.6 mL(标准状况)
D.B曲线表明原溶液通入CO2后,所得溶质与盐酸反应产生的最大体积为33.6 mL(标准状况)
命题人:李孝平 审题人:李白仲
一、二选择题:(1―10题每题2分,11-18每题3分,共44分)
题 号
1
2
3
4
5
6
7
8
9
10
答 案
B
D
A
B
D
C
C
B
B
C
题 号
11
12
13
14
15
16
17
18
答 案
D
B
B
C
C
D
A
A
三、填空题:(本题共5小题,共46分)
19、①、③、⑧; ②、④; ⑤; ⑥、⑦;(每空1分)
20、(1) 略 3分 ;(2)略 4分
(3)c3>c1>c2;CH3COOH; D。(各2分)
21、(1)、4;(2分) (2)、大于(1分);因为升温水的电离平衡右移,离子浓度增大,Kw增大;(2分)
22、(1)H-O-O-H(2分) (2)N2H4(l)+H2O2(l) == N2(g) +2H2O(l) △H=-644.25 KJ/mol(3分)(3)产物不会造成环境污染。(1分)
23、(10分)(1)1 (2分) (2)否、(2分) 大于(1分) 因为
试卷.files/image027.gif)
试卷.files/image029.jpg)
试卷.files/image031.jpg)
= = <K平衡向右移动(3分)
(3)增大 减小(各1分)
24、(1)加快 (2)D (3)40% 试卷.files/image033.gif) L (各2分)
L (各2分)
25、(10分)⑴、反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 ;
控制阴离子相同,排除阴离子的干扰 ; 将FeCl3改为Fe2(SO4)3
⑵、关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 一定时间内收集到的气体体积或收集一定体积的气体所需要的时间 ( 合理答案同样给分) 各2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com