
题目列表(包括答案和解析)
氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:
2Fe+3(SCN)2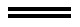 2Fe(SCN)3
2Fe(SCN)3
Ag++CN-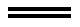 AgCN↓(白)
AgCN↓(白)
拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱。下列反应中,不正确的是( C )
A. 2CN-+Cl2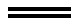 2Cl-+(CN)2
2Cl-+(CN)2
B. (CN)2+2OH-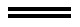 CN-+CNO-+H2O
CN-+CNO-+H2O
C. (CN)2+H2O 2H++CN-+CNO-
2H++CN-+CNO-
B. MnO2+4HSCN (SCN)2+Mn(SCN)2+2H2O
(SCN)2+Mn(SCN)2+2H2O
【解析】 从题中信息可以看出,拟卤素形成的无氧酸和含氧酸均为弱酸,书写离子方程式时不能拆开成离子。
同温同压同体积的两个密闭容器中分别充满12C18O和14N2两种气体。关于这两个容器中气体的说法正确的是( A )
A. 质子数相等,质量不等 B. 分子数和质量都不相等
C. 分子数和质量都相等 D. 原子数和中子数都相等
【解析】 根据阿伏加德罗定律,同温同压同体积的12C18O和14N2具有相同的分子数,而12C18O和14N2每个分子中都含14个质子,故质子数也相等,但因为二者的相对分子质量不同,故质量不同。
标准状况下,a L Cl2通入到1 L b mol/L的FeI2溶液中,充分反应后,所得溶液中Fe2+的物质的量浓度与a、b的关系如下表,请完成其余空格。
a、b的关系 | Fe2+的物质的量浓度(mol/L) |
a≤22.4b | ① b |
②a≥33.6b | 0 |
22.4b≤a≤33.6b | ③ |
【解析】根据微粒的还原性的相对强弱顺序:I->Fe2+>Br-,所以Cl2通入溶液中,①首先是将I-氧化成I2,②剩余的Cl2才可能将Fe2+氧化成Fe3+,即:
①FeI2+Cl2 FeCl2+I2
FeCl2+I2
②2FeCl2+Cl2 2FeCl3
2FeCl3
总反应为:2FeI2+3Cl2 2FeCl3+2I2
2FeCl3+2I2
从以上反应方程式不难看出:
当n(Cl2)≤n(FeI2)时,只有I-被氧化,Fe2+的浓度保持不变;
当n(Cl2)>n(FeI2)时,I-全被氧化,Fe2+部分或全部被氧化。
故Fe2+的浓度有如下三种情况:
(1)![]() ≤b mol,a≤22.4b c(Fe2+)=b mol/L
≤b mol,a≤22.4b c(Fe2+)=b mol/L
(2)![]() :b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0
:b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0
(3)22.4b≤a≤33.6b,Fe2+部分氧化c(Fe2+)=b-(![]() -b)×2 mol/L
-b)×2 mol/L
(7分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为 ,该元素为 元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【解析】根据元素在周期表中的位置可知T属于第三周期,T所处的周期序数与主族序数相等,所以T是Al,则Q是C,R是N,W是S。
(1)N是第ⅤA,所以第六周期、第ⅤA元素的原子序数是7+8+18+18+32=83,该元素是铅,属于金属元素。
(2)C是非金属,Al是金属,前者的非金属性强于后者。
(3)单质硫的化合价是0价,浓硫酸中硫的化合价是+6价,若二者反应的生成物只有2种,且一种是气体,因为生成物一定有水,则该气体只能是SO2。
(4)N的氧化物中相对分子质量最下的是NO。在反应中NO和O2的物质的量之比是4︰1,根据得失电子守恒可知NO的失去1个电子,化合价由+2价升高到+3价,因此含氧酸盐是NaNO2。
(7分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为 ,该元素为 元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【解析】根据元素在周期表中的位置可知T属于第三周期,T所处的周期序数与主族序数相等,所以T是Al,则Q是C,R是N,W是S。
(1)N是第ⅤA,所以第六周期、第ⅤA元素的原子序数是7+8+18+18+32=83,该元素是铅,属于金属元素。
(2)C是非金属,Al是金属,前者的非金属性强于后者。
(3)单质硫的化合价是0价,浓硫酸中硫的化合价是+6价,若二者反应的生成物只有2种,且一种是气体,因为生成物一定有水,则该气体只能是SO2。
(4)N的氧化物中相对分子质量最下的是NO。在反应中NO和O2的物质的量之比是4︰1,根据得失电子守恒可知NO的失去1个电子,化合价由+2价升高到+3价,因此含氧酸盐是NaNO2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com