
题目列表(包括答案和解析)
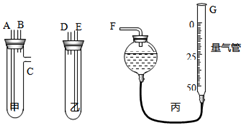
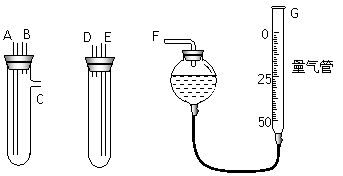
 (13分)某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。假如实验是在标准状况下进行,试回答下列问题:
(13分)某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。假如实验是在标准状况下进行,试回答下列问题:
(1)镁带和稀硫酸应分别置于_____、_____仪器中(填仪器编号);G管可以用化学实验室里的___________________(填仪器名称)改装。
(2)仪器丙由左、右两根部分组成,它们用橡皮管连通,并装入适量水,上下移动两管可以调节液面高低。甲乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,接口的连接方式如下:A接连___________,B接连___________,C接连___________(填写各接口的编号)。
(3)实验中要取用一定质量的镁条样品投入图示试管中,你认为________(填“能”或“不能”)用中学化学实验室常用的托盘天平,理由是_____________________________________。
(4)你取镁带样品的方法是:_____________。如果取镁带长a m,质量为 m g,截取镁带长x cm,产生气体体积为V mL,则测得标况下气体摩尔体积应表示为:V(m)=______________L∙mol-1。
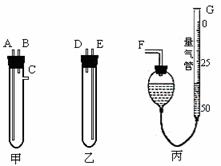
(13分)某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。假如实验是在标准状况下进行,试回答下列问题:
 |
甲 乙 丙
(1)镁带和稀硫酸应分别置于 、 仪器中(填仪器编号);G管可以用化学实验室里的一种常用仪器来改装,你认为这种仪器的名称是 ;
(2)仪器丙由左、右两个部分组成,它们用橡皮管连通,并装入适量水,上下移动两管可以调节液面高低。甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,接口的连接方式如下:A连接 ,B连接 ,C连接 ;(填写各接口的编号)
(3)实验中要取用一定质量的镁带样品投入图示试管中,你认为能否用中学化学实验室常用的托盘天平 ,理由是 ;
(4)你认为可用什么方法取镁带样品 ,如果取镁带长 l m,质量为m g,截取镁带长x cm,产生气体体积为V mL,则测得标准状况下气体摩尔体积应表示为:V(m)= L/mol。

(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。
①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
C
C
A
D
B
B
D
A
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
题号
10
11
12
13
14
15
16
17
18
答案
BC
CD
B
BD
C
BC
B
C
C
三、(本题包括3小题,共34分)
19. (13分)
(1)甲 、乙 ;50mL碱式滴定管(每空1分,3分)
(2)D、E、F(3分,全对给分)。
(3)不能(1分) 量气管的最大量程是50mL,只需
(4)用标准卷尺量取镁带(2分) 12Va/5mx(2分)
20.(10分)
(1)Fe3O4也能被磁铁吸附,故不能由此确定X就是铁单质。(2分)
(2) ①检验是否存在Fe3+,确认Fe3O4的存在(2分) ②Fe+2 Fe3+=3Fe2+ (2分)
(3) ①过滤、洗涤(2分) ②n(Fe3O4)=0.01mol;n(Fe)=0.01mol(2分)
21、(11分)
(1)他们类比的物质是Na2SO4,而Na2SO4具有以下化学性质:与BaCl2溶液反应生成沉淀;Na2SO4溶液呈中性,且不与酸反应;Na2SO4无还原性,不能被氧化剂氧化,因此他们提出以上猜想。(2分)
(2)
实验操作
实验现象或
预期实验现象
现象解释
(用离子方程式表示)
结论
猜想②
操作一:用玻璃棒蘸取Na2S2O3溶液,点滴到pH试纸的中央,将试纸呈现的颜色与标准比色卡对照

操作二:用滴管取少量Na2S2O3溶液于试管,然后逐滴滴入3 mol?L-1H2SO4,振荡
有淡黄色沉淀和无色刺激性气味气体产生
猜想③
操作三:用滴管取少量新制氯水于试管,然后逐滴滴加少量Na2S2O3溶液,振荡
氯水颜色变浅
S2O32―+4Cl2+ 5H2O=2SO42―+8Cl―+10H+
(操作1分,现象1分,离子方程式2分,共7分)
(3)用滴管取少量反应后的溶液于试管,向其中滴入氯化钡溶液,若观察到有白色沉淀产生,则说明Na2S2O3能被氯水氧化(2分)
四、(本题包括3小题,共34分)
22.(14分)
(1)四,ⅦB(各1分,共2分)
(2) Zn+H2SO4=ZnSO4+H2↑(2分)
(3) ①H2O2 (2分)
②在酸性条件下加入双氧水,将Fe2+氧化成Fe3+ ,2Fe2++ 2H2O2+ 2H+ = 2Fe3++ 2H2O
调节pH至3.7-8.6,使Fe3+沉淀完全, Fe3++
3H2O  Fe(OH)3 + 3H+ (4分)
Fe(OH)3 + 3H+ (4分)
③以BaS为沉淀剂,使Pb2+、Cd2+、Hg+等金属离子,生成更难溶的硫化物而除去。(2分)
(4)MnSO4+2NH4HCO3 = (NH4)2 SO4 +MnCO3 + H2O + CO2↑(2分)
23(8分)
(1)①脱硫处理 (1分) ②2NO+2CO N2+2CO2(2分)
N2+2CO2(2分)
(2)①正四面体(1分)②4.57 (或4.6) (2分)③NH4++NO2?=N2↑+2H2O(2分)
24 (12分)
(1)0.1 mol/(L?min);(2分)
(2)0.17;(2分)
(3)A.C.D(2分)
(4)小于(1分),温度不变,平衡常数不变,若加入0.8 mol A 、1.0mol B平衡浓度则与上图1中A浓度相同,投入量相当于0.8 mol A 、1.0mol B后再投入0.1molB ,平衡向正向移动(2分)
 |
(5)(每线2分,共4分,
起点在第7分钟,拐点在第9分钟,降低温度的图像超越0.6mol/L给0分)
五、(本题包括1小题,9分)
25(9分)
(1)、C8H16O4 (1分)(2)BrCH2-CH2Br(1分) ;HO-CH2-CH2-Br (1分)
(3)酯化反应(2分)
(4)、nHOOC-CH2OH→ + nH2O
(2分)
+ nH2O
(2分)
(5)、D(2分)
六、选做题(本题包括2小题,每小题10分,考生只能选做一题)
26.(10分)
(1)C15H16O2(1分) (2)D (2分)
(3) (2分) (4)羟基、羧基;(2分) 消去反应(1分)
(2分) (4)羟基、羧基;(2分) 消去反应(1分)
(5)

 (2分)
(2分)
27.(10分)
(1)D(2分)
(2)F-H…F F-H…O O-H…F O-H…O(写对2个给1分,共2分)
(3) SO2 (1分), 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大(2分)
(4) ZnO(2分);ZnO是原子晶体,而干冰是分子晶体。(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com