
题目列表(包括答案和解析)

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(16分)下图是某化工厂对海水资源的综合利用的示意图。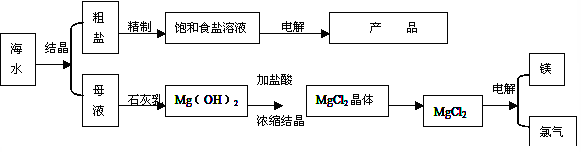
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是: (填物理变化、化学变化)
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的离子方程式为: 。阳极产生气体的如何检验 。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐: t。
(3)分离出粗盐的母液中含有Mg2+,从图中可看出对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳所起的作用是: 。
②从充分利用当地海洋化学资源,就地取材,经济效益的角度考虑,生产生石灰的原料可是: 。
③电解熔融氯化镁的化学方程式是: 。
④氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体。但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因: 。
(16分)下图是某化工厂对海水资源的综合利用的示意图。
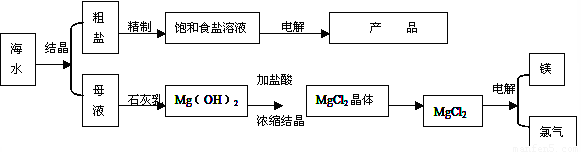
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是: (填物理变化、化学变化)
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的离子方程式为 : 。阳极产生气体的如何检验 。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐: t。
(3)分离出粗盐的母液中含有 Mg2+,从图中可看出对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳所起的作用是: 。
②从充分利用当地海洋化学资源,就地取材,经济效益的角度考虑,生产生石灰的原料可是: 。
③电解熔融氯化镁的化学方程式是: 。
④氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体。但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因: 。
生物参考答案
1、B 2、C 3、B 4、C 5、A
30.每空2分。(1)外显子,不遵循(2)注射特异性的抗原,灭活的病毒(或灭活的仙台病毒)(3)①限制性内切酶 DNA连接酶②检测目的基因在受体细胞中是否进行了表达(或检测受体细胞是否显示出目的基因控制的性状)既能无限增殖又能产生特定抗体(4)见下图(4分)
31.Ⅰ. 每空2分(1)浮游植物→浮游动物→鲫鱼→乌鱼;草→鼠→猫头鹰(2)浮游植物,鼠和猫头鹰
Ⅱ.(1)等量,(1分)将等量的相同大小的切片放在不同温度蒸馏水中处理1分钟取出;(1分)再分别放在等量的清水中浸泡1小时而获得不同的切片浸出物溶液。(1分)
(2)受50℃温度处理后膜的透性大大增加(1分)
(3)步骤1取两组等量的相同大小的切片,编号,一组加入A物质处理一段时间,另一组不作处理;(2分)
步骤2:将两组切片分别放在等量的清水中浸泡1小时而获得不同的切片浸出物溶液;(2分)
步骤3:测量两组溶液的花青素吸光度并进行比较。(2分)
结果与结论1:如果两组溶液的吸光度相同或相近,说明上述观点不正确;(2分)
结果与结论2:如果实验组的吸光度大于实验组,说明上述观点正确。(2分)
物理参考答案
14.A 15.D 16.BC 17.B 18.D 19.BC 20.A 21.CD
22.⑴ 0.900 ⑵0.80,0.64 (3)A2;R1;甲
23.解:(1)棒ab有最大速度vm时有:
∴……………………………………4分
(2)设下滑位移S所用时间为△t,则由 有
∴……………………6分(直接用 扣2分)
(3)从释放到棒达最大速度vm的过程中,克服安培力做了多少功就有多少其它形式的能转化为电能。由能量守恒有:
∴
……………………………………6分
24.(19分)解:(1)如图,电荷从A点匀加速运动到x轴的 C点即是电荷由C点第一次进入磁场,位移s=AC=m;加速度;满足:;
故时间 (6分)
(2)电荷到达C点的速度为速度方向与x轴正方向成450角,在磁场中运动时由得即电荷在磁场中的偏转半径为 (6分)
(3)轨迹圆与x轴相交的弦长为,所以电荷从坐标原点O再次进入电场中,且速度方向与电场方向垂直,电荷在电场中做类平抛运动,运动过程中电荷第三次经过x轴时位移方向角为45O,设运动的时间为,则:
得则电荷在垂直电场方向的位移
;即电荷第三次到达x轴上的点的坐标为(8 m,0). (7分)
25.(20分)
(1)设物体从A滑落至B时速率为
(2分)
(1分)
物体与小球相互作用过程中,系统动量守恒,设共同速度为
(1分)
(1分)
(2)设二者之间的摩擦力为
(2分)
(2分)
得 (2分)
(3)设物体从EF滑下后与车达到相对静止,共同速度为v2相对车滑性的距离为S1,
车停后物体做匀减速运动,相对车滑行距离为S1
(1分)
(1分)
(1分)
(2分)
联立解得 (1分) (1分)
(1分)
化学参考答案
题号
6
7
8
9
10
11
12
13
答案
B
D
D
C
C
C
B
B
26、(17分)
(1)Na+ (2)物理变化
(3)
28.(16分)
⑴ O=C=O -6 CO2+2Mg2MgO+C(3分)
⑵ 2Fe2++Br2=2Fe3++2Br- 2Fe3++Fe=3Fe2+(3分)
⑶ 2Fe2++4 Br-+3Cl2=2Fe3++2Br2+6Cl-(3分)
29.(19分)
(1)a、b
(2)干燥气体 控制氢气和氮气的流速
(3)不会(1分) 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)氨的催化氧化反应是一个放热反应 有红棕色气体产生
(5)4NH3+5O24NO+6H2O
(6)NH4+ NO3-(各1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com