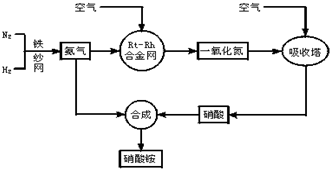
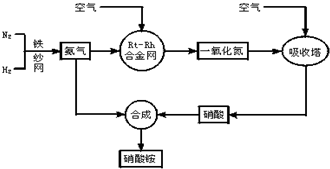
(4)如图
五、(本题共24分)
考生注意:26题为分叉题,分A、B两题,考生可以任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
 26.(A)(10分)
26.(A)(10分)
 (1)2CH3CHO+O2
2CH3COOH(2分)
(1)2CH3CHO+O2
2CH3COOH(2分)
(2)硅油的沸点是180℃以上,乙酸沸点为117.9℃,有利于乙酸蒸馏出来, 植物油
反应混合液中 具支试管支管品 117.7℃(5分)
(3)①取少量液体滴加紫色石蕊试液变红色(1分)
②用洁净 的玻璃棒蘸取试液到pH试纸上,测定pH值(1分)
③取少量溶液滴入到碳酸钠或碳酸钙固体中,产生大量气泡(1分)其它方法合理给分
(B)(10分)
(1)使甲苯和三氧化锰充分接触,加快反应速率。(2分)
(2)使生成物溶解度减小,以使固体析出(2分)
(3)稀硫酸、甲苯(2分)
(4)蒸馏 利用甲苯和苯甲酸的沸点差异使两者分离(2分)
(5)部分苯甲醛被氧化为苯甲酸(2分)
27.(14分)(3)①i→c→d→f→g→h→i→f→g→e(3分)
②B(2分)
③除去气体中的杂质(可能杂质是HCOOH、CO2、SO2)(1分)
 ④红棕色变为黑色 通一氧化碳冷却至室温(3分)
④红棕色变为黑色 通一氧化碳冷却至室温(3分)
⑤Fe2O3+3CO 2Fe+3CO2
⑥气体安静燃烧,发出兰色火焰, 点燃有爆鸣声(或有火球喷出),收集的气体不纯净。(3分)
六、(本题共20分)
 28.(8分)(1)乙醇(1分)
28.(8分)(1)乙醇(1分)
(2)CH3COOH+CH3+CH2OH
CH3COOH2CH3+H2O(2分)
(3)CH3CH(OH)COOH CH3COOCH(CH3)COOCH2CH3; 酯化反应(各1分共3分)

 (4)
(4)

 nCH3=CH2
[ CH2―CH2
] n 或CH3=CH2+H2O
CH3CH2OH (2分)
nCH3=CH2
[ CH2―CH2
] n 或CH3=CH2+H2O
CH3CH2OH (2分)
|
|

29.(1) (2分) (2)①水解反应
加成反应(2分)
|
|

②  ③ ③
 BrCH2―C(CH3)=CH―CH2Br+2NaOH
CH2(OH)―C(CH3)=CH―CH2(OH)+2NaBr; BrCH2―C(CH3)=CH―CH2Br+2NaOH
CH2(OH)―C(CH3)=CH―CH2(OH)+2NaBr;
HOOC―C(CH3)=CH―COOH+2CH3CH2OH
H5C2OOC―C(CH3)=CH―COOC2H5+H2O

七、(本题共16分) 30.(1)原混合物中碳酸钾的质量分数(3分) 55.4% (2)40g/100gH2O 31.(1)1:2(2分) (2)77.8%(2分) (3)3(2分) (4)NO N2 H2 NO2 NH4+(2分) 5:3:1:1:4(2分)
| | | | | |