
题目列表(包括答案和解析)
(12分)氢是最小的原子,但是它对于世界上物质结构和种类的丰富性却起着举足轻重的作用。氢与许多元素都能形成简单的无机小分子,其分子结构往往与中心原子的性质有关。
⑴ NH3、PH3、AsH3、SbH3分子的键角分别为107.3、93.3、91.8、91.3度,试解释其键角逐渐减小的原因 。
⑵ 试预测CH4、NH3、H2O分子的键角大小顺序 。
⑶ 最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。
① 重冰属于立方晶系,结构如左下图,晶胞参数a=0.333.7pm(即图中立方体的边长,1pm=10-12m),计算其密度为 。其中氧原子的杂化方式为 。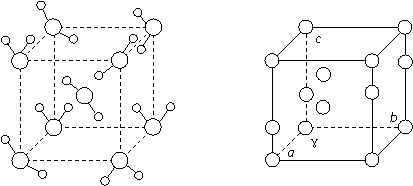
② 普通冰属于六方晶系,晶胞参数为a=452pm,c=737pm,γ=120°,如右上图,白球表示氧原子,一个晶胞中有4个水分子,计算其密度为 。并与重冰比较,可能的原因为 。
| 催化剂 |
| 1 | 2 |
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
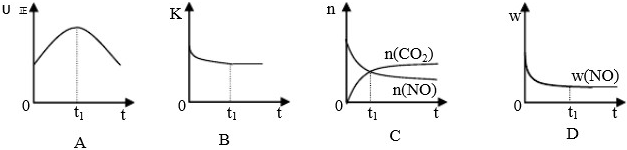
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。

③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
你认为下列说法不正确的是( )
| A.氢键存在于分子之间,不存在于分子之内 |
| B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大 |
| C.NH3极易溶于水而CH4难溶于水的原因是NH3是极性分子,CH4是非极性分子 |
| D.冰熔化时破坏分子间作用力和氢键 |
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
D
D
D
A
C
D
C
D
二、选择题
题号
11
12
13
14
15
答案
A
C
B
AC
BC
三、填空、简答和计算
16.(1)NaCl;H2S;N2;NaOH;Na2O2。

17.Na2O, K2S, MgF2, CaCl2
18.(1) ;共价。
;共价。
(2)离子;
(3) ;共价。
;共价。
|