
题目列表(包括答案和解析)
(8分) 二甲醚(CH3OCH3)简称CME,是一种理想的煤基清洁燃料,可由生物甲烷或天然气合成。合成二甲醚主要步骤为造气和合成。过程如下:
![]()
 |
![]()
![]()
![]()
![]()
(1)生物甲烷是由植物在一定条件下发酵(代谢产物为相等物质的量的CH4和CO2 )而制得,植物纤维素发酵制得甲烷的化学方程式为 。
![]() (2)若162 kg纤维素含量为10%的农作物桔杆,在微生物作用下完全转化为CH4和CO2,通入适量的水蒸气合成二甲醚,理论上最多可得到 kg的二甲醚。
(2)若162 kg纤维素含量为10%的农作物桔杆,在微生物作用下完全转化为CH4和CO2,通入适量的水蒸气合成二甲醚,理论上最多可得到 kg的二甲醚。
![]() (3)若天然气中只含CH4,空气中只含N2和O2,且体积比为4∶1。某企业用标准状况下22.4 m3天然气及水蒸气、空气为原料生产二甲醚,同时利用N2与H2合成氨。在合成二甲醚的同时,理论上还可得到多少千克的NH3?(假设天然气完全反应后的N2全部转化为NH3,且生产过程中转化率均为100%;合成塔中水与CO不反应)
(3)若天然气中只含CH4,空气中只含N2和O2,且体积比为4∶1。某企业用标准状况下22.4 m3天然气及水蒸气、空气为原料生产二甲醚,同时利用N2与H2合成氨。在合成二甲醚的同时,理论上还可得到多少千克的NH3?(假设天然气完全反应后的N2全部转化为NH3,且生产过程中转化率均为100%;合成塔中水与CO不反应)

 |
二甲醚(CH3OCH3)是一种新型的合成“柴油”.它可由生物甲烷或天然气合成.
(1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
![]() ,若某植物纤维素(C6H10O5)n的含量为10%,某沼气池,当加入该植物162 kg,在微生物作用下完全转化可得CH4在标准状况下的体积为________m3.
,若某植物纤维素(C6H10O5)n的含量为10%,某沼气池,当加入该植物162 kg,在微生物作用下完全转化可得CH4在标准状况下的体积为________m3.
(2)合成二甲醚主要步骤为造气和合成.过程如下:

若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其它杂质,每100 m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2且体积比为4∶1,下同),才能保证合成时CO和H2充分利用.V[H2O(g)]=________m3;V(空气)=________m3.
(3)为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O→CO+3H2 ②2CH4+O2→2CO+4H2
合成塔I:CO+2H2→CH3OH,2CH3OH→CH3OCH3+H2O;
合成塔II:![]()
假设天然气中只含CH4,反应②中通入适量空气,通过调节①和②中投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰为3∶1,以便合成氨.该企业每生产34tNH3理论上同时可以得到二甲醚多少吨(设工业经多次转化,总转化率假定为100%,设合成塔I中水与CO不反应)?
二甲醚(CH3OCH3)是一种新型的合成“柴油”。它可由生物甲烷或天然气合成。
⑴生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
![]()
若某植物纤维素的含量为10%,某沼气池,当加入该植物162kg,在微生物作用下完全转化可得CH4在标准状况下的体积为 m3。
⑵合成二甲醚主要步骤为造气和合成。过程如下:
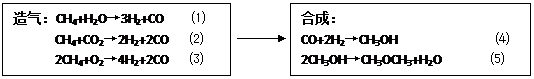 |
若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其他杂质,每100m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2,且体积比为4:1,下同),才能保证合成时CO和H2充分利用。V[H2O(g)]= m3;V[空气]= m3。
⑶为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O → CO+3H2 ②2CH4+O2 → 2CO+4H2
合成塔Ⅰ:CO+2H2 → CH3OH ; 2CH3OH → CH3OCH3+H2O
合成塔Ⅱ:N2+3H2==2NH3
假设天然气中只含CH4,反应②中通入适量空气,调节①和②投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰好为3:1,以便合成氨。该企业每生产34t NH3理论上同时可以得到二甲醚多少吨?(设工业多次转化,总转化率假定为100%设合成塔Ⅰ中水与CO不反应)?

| 气体 | CH3OCH3 | H2O | N2 | A |
| 体积(m3) | 95 | 95 | x | y |
1.D 2.D 3.B 4.D 5.D 6.B 7.A 8.C
9.C 10.AB 11.D 12.C 13.C 14.C
15.(1)检验反应中生成的H2 (2分)
(2)Fe Fe3O4溶于盐酸生成的Fe3+ 与Fe反应生成了Fe2+ (2分)
(3)① 2Fe2++2H++H2O2=2Fe3++2H2O (2分)
②取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,表明沉淀已洗涤干净 (2分)
③固体样品质量和红褐色固体的质量 (2分)
(本题共10分,其它合理答案参照给分)
 (3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(3)相同温度下,K2SO4 的溶解度小于KCl、(NH4)2SO4
及NH4Cl
(4)CaO、H2O 或Ca(OH)2
(5) 原子利用率高,没有有害物质排放到环境中 (每空2分,共10分)
19.(1)  (2)酸性KMnO4溶液 (3) 3
(2)酸性KMnO4溶液 (3) 3
(4) 
 |
(6) 
 (每空2分,共12分)
(每空2分,共12分)
20.(1) (C6H10O5)n+nH2O 3nCH4↑+3nCO2↑ (2分)
(2)9.20 (
(3) 设反应③中消耗O2的物质的量为x,则N2的物质的量为4x
2CH4+O2→4H2+2CO CH4 + H2O → 3H2 + CO
2x x 4x 2x 1×103-2x (1×103-2x)×3 (1×103-2x)
合成二甲醚反应中CO和H2为1∶2,合成氨反应中,N2与H2体积比为1∶3,则
4x+(1×103-2x)×3-[2x+(1×103-2x)]×2=4x×3 (3分,关系式)
x=1000/14 mol
NH3
:4x×2×17=
答略。(本题共10分,其它合理答案参照给分)
21.(1) 1s22s22p63s23p63d54s2 (2分)
Mn2+的3d轨道电子排布为半满状态较稳定 (2分)
(2) 直线型 (2分) CO2 (2分)
(3) 1:2 (1分)  (1分) 30 (2分)
(1分) 30 (2分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com