
题目列表(包括答案和解析)
 甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
| ||
| ||
| 烯经被氧化的部位 | CH2= | RCH= |
 |
| 氧化产物 | CO2 |  |
 |









| Y | V | |||
| X | W |
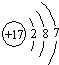
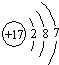
| ||
| ||



 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.

| ||
| ||
 A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).
A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).

| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com