
题目列表(包括答案和解析)
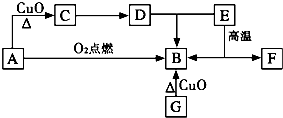 A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一.C的溶液能发生银镜反应,反应后的溶液经酸化可得D.G为单质,其原子最外层电子数为次外层的2倍.F中阴阳离子个数比为1:1,其阳离子与Ar具有相同的电子层结构,A-F的转化关系如图.?
A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一.C的溶液能发生银镜反应,反应后的溶液经酸化可得D.G为单质,其原子最外层电子数为次外层的2倍.F中阴阳离子个数比为1:1,其阳离子与Ar具有相同的电子层结构,A-F的转化关系如图.?A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一.C的溶液能发生银镜反应,反应后的溶液经酸化可得D.G为单质,其原子最外层电子数为次外层的2倍.F中阴阳离子个数比为1∶1,其阳离子与Ar具有相同的电子层结构,A-F的转化关系如图.
(1)D与E反应生成B的离子方程式:________.
(2)单质G中的元素位于第________周期________族.
G与F在高温下反应生成固体H和一种还原性气体,H与H2O反应生成可燃性气体I,I可通过两步反应制得A.请写出:
(3)I的结构式:________.
(4)由I制备A的两步反应的化学方程式:________,________.
(5)G与F在高温下反应生成固体H的化学反应方程式:________.
乙醇是日常生活中最常见的有机物之一,乙醇的一种工业制法如下:
乙烯+A CH3CH2OH
CH3CH2OH
请回答下列问题:
(1)反应物乙烯的电子式为
________________________________________________________________________;
已知该反应中原子利用率为100%,符合绿色化学思想,则反应物A的化学式为________________。
(2)工业上还可以用硫酸为吸收剂的间接水合法合成乙醇,从对设备的影响和产品分离角度分析该法与固体催化剂法相比,缺点是
________________________________________________________________________。
(3)乙酸和乙醇在一定条件下可发生反应生成一种有香味的物质,该反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
该反应是可逆反应,请说出提高反应物转化率的一种方法:
________________________________________________________________________。
(4)固体酒精是一种便携的燃料,其中一种制备方法是将饱和醋酸钙溶液加入酒精中致使醋酸钙从酒精溶液中析出,呈半固态的凝胶状物质——“胶冻”,酒精填充其中,点燃胶状物时,酒精便燃烧起来。该过程说明醋酸钙在酒精中的溶解度________(填“大于”或“小于”)醋酸钙在水中的溶解度。
| |||||||||||||||||||||||||||||

 则n值为_________。
则n值为_________。
考试时间:
一、选择题(每小题6分,共48)
14、BD 15、BC 16、AC 17、AB 18、C 19、A 20、ABD 21、BD
二、非选择题
22、 (17分)(Ⅰ) (5分)
(5分)
(Ⅱ)(1)0.78 (3分) 0.39 (3分) (2) 0.20 (6分)
23、(14分)
解:在m落在砂箱砂里的过程中,车及砂、泥球组成的系统的水平方向动量守恒,则有:
 ①
(2分)
①
(2分)
得: (1分)
(1分)
此时物块A继续向右做匀速直线运动再与轻弹簧相碰,以物块A、弹簧、车系统为研究对象,系统动量守恒,当弹簧被压缩到最短,达最大弹性势能Ep时,整个系统的速度为v2,
则由动量守恒和机械能守恒有:
 ②
(3分)
②
(3分)
 ③
(3分)
③
(3分)
由②式解得: (2分)
(2分)
由③式解得: (3分)
(3分)
(其他解法正确的酌情给分。)
24、(19分)
解:(1)物体A滑上平板车B以后,物体作匀减速运动,平板车作匀加速运动,两者速度相同时,物体A在平板车上相对小车向前滑行的距离最大。
由牛顿第二定律,对物体A有:µmg =maA 得aA=µg=
对平板车B有:  ①
①
得:aB=
两者速度相同时,有 得:t=0.25s
(2分)
得:t=0.25s
(2分)
此过程:A滑行距离: m
(1分)
m
(1分)
B滑行距离: m
(1分)
m
(1分)
此时物体A相对小车向前滑行的距离最大:△s= SA- SB=
(2)物体A不从车右端滑落的临界条件是A到达B的右端时,A、B具有共同的速度v1,
则: ………②
(2分)
………②
(2分)
又:
 ……………③
(2分)
……………③
(2分)
由② ③式,可得:aB=
代入①式得: F=M aB―µmg=1 N (1分)
若F<1N,则A滑到B的右端时,速度仍大于B的速度,于是将从小车B的右端滑落。
当F较大时,在A到达B的右端之前,就与B具有相同的速度,之后,A必须相对B静止,才不会从B的左端滑落。
即有:F=(M+m)am, (2分)
µm
解之得:F=3N (1分)
若F大于3N,A就会从小车B的左端滑下。
综上:力F应满足的条件是: 1N≤F≤3N (1分)
(其他解法正确的给分。)
25、(22分)
解:(1)如图所示,金属球A由a到b过程做匀加速直线运动,细绳与水平方向夹角为600时突然绷紧。
由题意 
故电场力和重力的合力: ,
,
 由动能定理得
由动能定理得  , (2分)
, (2分)
求得: ;
(2分)
;
(2分)
在b点细绳突然绷紧时,小球只剩下切向速度;
 (2分)
(2分)
球A由b到c过程中,细绳的拉力对A球不做功,
由动能定理得
 (2分)
(2分)
解之得: (3分)
(3分)
(2)A球与B球碰撞动量守恒和机械能不损失有:


解得 =
=
A球与B球接触过程电荷量守恒有 ;
(1分)
;
(1分)
B球由碰后到落地过程中竖直方向做自由落体运动:
 (1分)
(1分)
 =
= (2分)
(2分)
水平方向匀加速直线运动, ; (1分)
; (1分)
所以  (2分)
(2分)
则B球落地速度是  (1分)
(1分)
理综化学部分参考答案
一、选择题:6. B 7.A 8. B 9. A 10. C 11.C 12. B 13. D
二、非选择题
26.(14分)
(1)O、S、Cl、Na、H(每空1分)
(2)
2Na2O2 + 2H2O==4NaOH + O2↑(或2H2O2 2H2O
+ O2↑)(3分,其它合理答案也给分,如:NaClO3受热分解等)
2H2O
+ O2↑)(3分,其它合理答案也给分,如:NaClO3受热分解等)
(3)MnO2
+ 4H + + 2Cl -  Mn2
+ + Cl2↑ + 2H2O (3分,其它合理答案也给分,如:KMnO4与浓HCl等)
Mn2
+ + Cl2↑ + 2H2O (3分,其它合理答案也给分,如:KMnO4与浓HCl等)
(4) 取少量试液,先用盐酸酸化(1分),若溶液中无沉淀产生,再加入BaCl2溶液(1分),如果有白色沉淀出现(1分),则说明原溶液中有SO42-存在。(共3分,用盐酸酸化的BaCl2溶液得0分)
27.(15分)
(1)Fe + 2HCl==FeCl2 + H2↑(3分),2Na + 2H2O + FeCl2==Fe(OH)2↓ + 2NaCl + H2↑(3分)(共6分,也可写成3个:Fe + 2HCl==FeCl2 + H2↑,2Na + 2H2O==2NaOH + H2↑,2NaOH + FeCl2==Fe(OH)2↓ + 2NaCl,则每个2分,多写出2Na + 2HCl==2NaCl + H2↑,NaOH + HCl==NaCl + H2O等的不扣分)
(2)在具支试管的出口处用向下排空气法收集满一试管气体(1分),用拇指堵住管口,移向酒精灯火焰(1分),松开拇指,若听到“扑”的一声(1分)则说明空气已排尽。(3分,其它合理答案也给分)
(3)钠不停地上下移动(1分),并有气泡产生(1分),很快有白色沉淀出现(1分)(共3分,答其它现象如:熔化成闪亮的小球,在煤油与界面间上下移动,钠粒最后消失等的不扣分)。
(4) A。(3分,估算,B选项中盐酸的量太大,溶液呈酸性,不能生成氢氧化亚铁,也不符合节约药品的原则)
28.(16分)
(1) CaCO3 + 2CH3COOH==Ca2+ + 2CH3COO- + CO2↑ + H2O;(3分)
(2) 2,IVA(各1分,共2分)



 (3)
H C C H(各1分,共2分)
(3)
H C C H(各1分,共2分)

 (4) CH CH + H2
(4) CH CH + H2  CH2 CH2
CH2 CH2
 CH2 CH2
+ H2O
CH2 CH2
+ H2O  CH3CH2OH(每个方程式3分,共6分,未注明条件不扣分)
CH3CH2OH(每个方程式3分,共6分,未注明条件不扣分)
 (CH CH + H2O
(CH CH + H2O CH3CHO,CH3CHO + H2
CH3CHO,CH3CHO + H2  CH3CH2OH也正确 )
CH3CH2OH也正确 )
(5) CaO + 3C  CaC2
+ CO↑(3分)
CaC2
+ CO↑(3分)
29.(15分)
(1)三角锥,极性。(每空2分)
NCl3 + 3H2O==3HClO + NH3↑(3分)。
 (2)
2NCl3(l)==N2(g) + 3Cl2(g);△H= 456kJ/mol (3分)。
(2)
2NCl3(l)==N2(g) + 3Cl2(g);△H= 456kJ/mol (3分)。
(3)n(NH4+)
= n(NH4Cl) = = 0.0150mol
= 0.0150mol
由反应NCl3+4HCl ==NH4 Cl + 3Cl2(1分)可知:
m (NCl3) = 0.0150mol×120.5g/mol =1.81g(1分)
反应生成的Cl2的质量为:0.0150mol×3×71g/mol =3.20g
原Cl2的质量为:51.4g ?3.20g = 48.2g (1分)
NCl3的质量分数为: ×100% = 3.62%<4%(1分)
×100% = 3.62%<4%(1分)
所以该样品是安全的。(1分)
(结果在3.60%到3.64%之间均合理,其它合理解题方法请参考以上标准给分,共5分)
理综生物部分参考答案
一、选择题(每小题6分)
1、C 2、C 3、D 4、B 5、B
二、非选择题(共42分)
30.(22分)
Ⅰ.(14分)
(1)(本小题5分)全能性(本空1分) 排列疏松、高度液泡化、薄壁细胞(本空2分) 脱分化(本空1分) 再分化(本空1分)
(2)(本小题3分) BCD
(3)(本小题6分)① 配制一定浓度的只缺硼元素的“完全培养液”;
② 在其他条件均适宜的环境中培养番茄;
③ 待番茄开花时,配制一定浓度的2,4?D溶液,进行喷洒即可获得。
〖每步骤2分,共6分。在回答配制培养液和2,4?D溶液时,缺少“一定浓度(或适宜浓度)”,各只给1分。〗
Ⅱ.(8分)
(1)(本小题4分,每空1分)C4 C3 维管束鞘 合理密植
(2)(本小题2分)蒸腾作用减弱,矿质元素运输受阻
(3)(本小题2分)
大豆根瘤菌可以固氮,根瘤破溃后,可以提高土壤含氮量(或答玉米和大豆根系分布于不同土层,可充分利用不同土层中的氮素)。
31.(20分)
(1)(本小题8分,每空2分)左右后肢均不收缩 左后肢不收缩,右后肢收缩
突触 ATP  ADP + Pi + 能量
ADP + Pi + 能量
(2)(本小题2分,答出2点即可)反应速度较缓慢、作用范围较广泛、作用时间较持久
(3)(本小题10分)
步骤三:①(本空1分)手术伤口对实验结果(观察现象)的干扰。
② (本空1分)甲状腺
步骤四(本空2分):当两只狗出现明显差异后,给甲狗补充适宜浓度的甲状腺激素,乙狗不补充,正常喂养一段时间后,观察比较它们之间的差异。
涉及的实验原理有(本空6分):甲状腺激素由甲状腺分泌产生(1分);甲状腺激素具有促进生长发育、促进新陈代谢、提高神经系统兴奋性的功能(3分);动物体内若缺乏甲状腺激素,会表现出生长发育停止、精神萎靡(或活动次数减少,反应迟钝等)、食欲不振(或食量减小等)症状(1分,答出一点即可),补充甲状腺激素后恢复正常(1分)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com